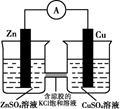
氧化还原反应的电子转移数目计算 知识点题库
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O。关于该反应的下列说法正确的是( )
A . NaNO2是氧化剂
B . 每生成1 mol N2转移的电子的物质的量为6 mol
C . NH4Cl中的氮元素被还原
D . N2既是氧化剂,又是还原剂
化工厂用来检查氯气管道是否漏气的反应为:3Cl2+8NH3→N2+6NH4Cl.
-
(1) 在该反应中,被还原的元素是;作为还原剂的物质是.
-
(2) 在方程式上标出电子转移的方向和数目.
-
(3) 若标准状况下有33.6LCl2参加反应,则被氧化的NH3的物质的量为 mol.
-
(4) 已知当氨气不足量时,反应产物是N2和HCl.若某次反应所得产物中,NH4Cl和HCl的物质的量相等,则参加反应的Cl2和NH3的物质的量之比为.
已知有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
-
(1) Cl2、KMnO4、H2SO4三者氧化性强弱顺序为,Cl-、SO2、Mn2+三者还原性强弱顺序为。
-
(2) 反应①中氧化产物和还原产物的质量之比为。
-
(3) 反应②中浓盐酸表现出的性质是________。A . 还原性 B . 酸性 C . 氧化性
-
(4) 用双线桥法标出反应②电子转移的方向和数目
根据金属及其化合物的所学知识回答下列问题:
-
(1) 常温下,在没有氧气存在时,铁与水几乎不反应,但在高温时,铁能与水蒸气反应,写出化学反应方程式:。
-
(2) 待(1)中反应完全,反应产物中Fe元素化合价为,该产物与盐酸反应的离子方程式为:。
-
(3) 将铁粉投入到盛有Cu2+和Fe3+的溶液中,反应完毕时,若烧杯底部有固体剩余,在所涉及的金属元素内溶液中一定不含有的金属离子是(填离子符号),写出证明溶液中不含有该离子的实验操作:。
-
(4) 某同学将铁、铜混合粉末14.8 g加入到100 mL 4.0 mol/L FeCl3溶液中,充分反应后,烧杯底部还有剩余固体,其质量为2.8 g,则原固体混合物中铜的质量是g,反应所得溶液中的Fe2+物质的量为mol。
下列表示电子转移的方向和数目错误的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 , 请根据要求回答下列问题:
-
(1) 反应过程中,被氧化与被还原的元素的物质的量之比为。
-
(2) 写出该反应的化学方程式,并标出电子转移的方向和数目:。若反应中生成0.2molHNO3 , 转移的电子数为个。
-
(3) NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是(写出2点)、。
-
(4) 一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有(填化学式)。
过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2
的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。
-
(1) Na 原子的核外电子排布式为,O 原子核外 L 层上有种能量不同的电子,H2O2 的电子式是
-
(2) 设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论);并用原子结构知识对作出的结论进行解释。
-
(3) 用一个离子方程式表示过碳酸钠溶液显碱性的原因。
-
(4) 高锰酸根离子(
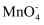 )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下: 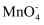 +CO
+CO  +H2O2→MnCO3¯+ +OH-+H2O
+H2O2→MnCO3¯+ +OH-+H2O 补全并配平上述化学反应过程式;反应中,过碳酸钠起沉淀剂和剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1 , 则转移电子数为mol(保留 2 位小数)
 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A .  ,
,  完全反应转移的电子数为
完全反应转移的电子数为 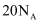 B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为
B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为  时,阳极应有
时,阳极应有  转化为
转化为  C . 常温下,
C . 常温下, 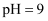 的
的 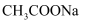 溶液中,水电离出的
溶液中,水电离出的  数为
数为  D .
D . 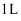 浓度为
浓度为 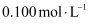 的
的  溶液中,阴离子数为
溶液中,阴离子数为 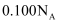
 ,
,  完全反应转移的电子数为
完全反应转移的电子数为 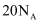 B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为
B . 用电解粗铜的方法精炼铜,当电路中通过的电子数为  时,阳极应有
时,阳极应有  转化为
转化为  C . 常温下,
C . 常温下, 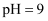 的
的 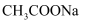 溶液中,水电离出的
溶液中,水电离出的  数为
数为  D .
D . 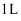 浓度为
浓度为 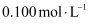 的
的  溶液中,阴离子数为
溶液中,阴离子数为 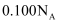
下列实验方案中,能达到相应实验目的的是( )
| 选项 | A | B | C | D |
| 目的 | 验证锌与硫酸铜反应过程中有电子转移 | 探究亚硝酸钠的氧化性 | 实验室制备乙酸乙酯 | 实验室制备氨气 |
| 实验方案 | | | | |
A . A
B . B
C . C
D . D
24mL浓度为0.05mol/L的Na2SO3溶液恰好与20mL浓度0.02mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )
A . +2
B . +3
C . +4
D . +5
氮化铝(AlN)具有耐高温‘抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO下列有关说法正确的是( )
A . 在氮化铝的合成反应中,N2是还原剂
B . 上述反应中,CO是氧化产物
C . 上述反应中AlN中N的化合价是+3
D . 上述反应中每生成CO 11.2L,则转移的电子数为NA
在反应 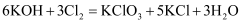 中,失电子与得电子的原子个数比是( )
中,失电子与得电子的原子个数比是( )
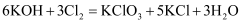 中,失电子与得电子的原子个数比是( )
中,失电子与得电子的原子个数比是( )
A . 1:5
B . 1:4
C . 1:3
D . 1:2
若NA表示阿伏加德罗常数,下列说法正确的是( )
A . 标准状况下,22.4 L氦气中含有的电子数为2NA
B . 7.8 g Na2O2与足量水反应转移电子数为0.2NA
C . 100 g 98%的浓硫酸中,氧原子总数为4NA
D . 0.2NA的Al与足量的NaOH溶液反应产生H2的体积为6.72 L
二氧化硫测量计工作的反应原理为:SO2+Br2+2H2O=H2SO4+2HBr,设NA为阿伏加德罗常数的值。下列有关说法正确的是( )
A . 2.24 LSO2参与反应破坏水中氢氧键数目为0.4 NA
B . 反应生成0.1 mol H2SO4时,溶液中含有阳、阴离子数目为0.3 NA
C . 在常温常压下16 g液态溴中原子数目为0.2 NA
D . 反应生成0.2 mol H+ , 转移电子数目为0.2 NA
利用间接成对电化学合成间氨基苯甲酸的工作原理如图所示。下列说法错误的是( )

A . 阳极的电极反应式为:2Cr3++7H2O-6e-=Cr2O  +14H+
B . 阳极槽外氧化反应为:
+14H+
B . 阳极槽外氧化反应为:  +Cr2O
+Cr2O  +8H+→
+8H+→  +2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
+2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
 +14H+
B . 阳极槽外氧化反应为:
+14H+
B . 阳极槽外氧化反应为:  +Cr2O
+Cr2O  +8H+→
+8H+→  +2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
+2Cr3++5H2O
C . 通电时阳极区pH增大
D . 当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
酸性条件下,可发生反应:M2O  +6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O
+6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O  中M化合价是( )
中M化合价是( )
 +6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O
+6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O  中M化合价是( )
中M化合价是( )
A . +4
B . +5
C . +6
D . +7
设NA代表阿伏加德罗常数的数值,下列有关说法正确的是( )
A . 3mol的NO2与H2O完全反应时转移的电子数为2NA
B . 46gC2H6O中一定含有NA个羟基
C . 1L0.1mol/LNa2CO3溶液中含CO  数为0.1NA
D . 密闭容器中2molSO2与1molO2反应,生成SO3的分子数为2NA
数为0.1NA
D . 密闭容器中2molSO2与1molO2反应,生成SO3的分子数为2NA
 数为0.1NA
D . 密闭容器中2molSO2与1molO2反应,生成SO3的分子数为2NA
数为0.1NA
D . 密闭容器中2molSO2与1molO2反应,生成SO3的分子数为2NA
已知 K2R2O7是一种强氧化剂,酸性条件下 0.2mol K2R2O7 恰好能将 1.2 mol FeO 氧化,其产物为 Rx+ , 则 x 的值为( )
A . 1
B . 2
C . 3
D . 4
用 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
A . 常温常压下,48g  和
和 含有的氧原子数均为3
含有的氧原子数均为3 B . 标准状况下,22.4L
B . 标准状况下,22.4L  含有的分子数为
含有的分子数为 C . 标准状况下,11.2L
C . 标准状况下,11.2L 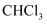 中含有
中含有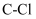 键的数目为0.5
键的数目为0.5 D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
 和
和 含有的氧原子数均为3
含有的氧原子数均为3 B . 标准状况下,22.4L
B . 标准状况下,22.4L  含有的分子数为
含有的分子数为 C . 标准状况下,11.2L
C . 标准状况下,11.2L 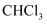 中含有
中含有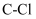 键的数目为0.5
键的数目为0.5 D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
NSR技术能降低柴油发动机在空气过量条件下NOx的排放,其工作原理如图所示。下列说法错误的是( )

A . 降低NOx排放可以减少酸雨的形成
B . 储存过程中NOx被氧化
C . 还原过程中消耗1molBa(NO3)2转移的电子数为5NA(NA为阿伏加德罗常数的值)
D . 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原
最近更新