氧化还原反应的电子转移数目计算 知识点题库
如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
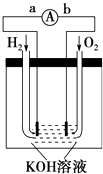
-
(1) 氢氧燃料电池的能量转化的主要形式是由,在导线中电子流动方向为(用a、b表示).
-
(2) 负极反应式为.
-
(3) 电极表面镀铂粉的原因是.
-
(4) 该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ2Li+H2
 2LiH
2LiHⅡLiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是,反应Ⅱ中的氧化剂是.(均填化学式)
②已知LiH固体密度为0.82g/cm3 , 用锂吸收224L(标准状况)H2 , 则被吸收的H2体积与生成的LiH体积比为.
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol.
-
(1) Al与Fe3O4发生铝热反应的化学方程式为,该反应中氧化剂是,还原剂是。
-
(2) 工业上电解冶炼铝的化学方程式为。若电路中通过1 mol电子,可以得到Al g。
 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
-
(1) 请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是。
②属于化合反应,但不是氧化还原反应的是。
③既属于化合反应,又是氧化还原反应的是。
④属于分解反应,但不是氧化还原反应的是。
⑤不属于四种基本反应类型的氧化还原反应的是。
A.2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑B.2Na+Cl2
 2NaCl
2NaClC.Zn+CuSO4=ZnSO4+Cu
D.2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑E.CaO+CO2=CaCO3
F.4FeS2+11O2
 2Fe2O3+8SO2
2Fe2O3+8SO2 -
(2) 根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是,还原产物是。
②氧化剂与氧化产物的物质的量比是。
③当有2 mol HNO3参加反应时,被氧化的物质质量为g。
 Pb+SO2。
Pb+SO2。
-
(1) 请将上述反应用单线桥法标出电子转移的方向和数目:
-
(2) 上述反应的氧化剂是 ,还原剂是,氧化产物是,还原产物是。
-
(1) 氧化剂,还原剂;
-
(2) 氧化产物,还原产物;
-
(3) 氧化剂与还原剂的质量之比;
-
(4) 用单线桥的方法表示该反应的电子转移情况;
-
(5) 用双线桥的方法表示该反应的电子转移情况。
 →Mn2+ 、HNO2→NO 、 IO
→Mn2+ 、HNO2→NO 、 IO  →I2 、Cl2→Cl-。如果分别用数量相等的这些物质氧化足量的KI,得到的I2最多的是( )
→I2 、Cl2→Cl-。如果分别用数量相等的这些物质氧化足量的KI,得到的I2最多的是( )
 B . HNO2
C . IO
B . HNO2
C . IO  D . Cl2
D . Cl2
-
(1) 反应中转移电子的物质的量为mol。
-
(2) 反应产生的混合气体中,产生NO气体的体积为mL(标准状况下测定)。
-
(3) 反应后,NO
 的物质的量浓度为mol/L。
的物质的量浓度为mol/L。
-
(1) 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O
 +O2+4OH-=Fe3O4↓+S4O
+O2+4OH-=Fe3O4↓+S4O  +2H2O
+2H2O ①参加反应的氧化剂与还原剂的物质的量之比为。
②若有2molFe2+被氧化,则被Fe2+还原的O2的物质的量为mol。
③每生成1molFe3O4 , 反应转移的电子为mol。
-
(2) 往含Fe3+、H+、NO
 的混合液中加入少量SO
的混合液中加入少量SO  ,反应的离子方程式为。
,反应的离子方程式为。
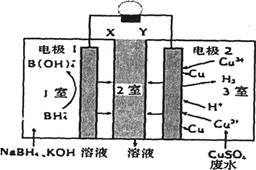
 +8OH--8e-=
+8OH--8e-= 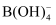 +4H2O
C . 2室流出的溶液中溶质为Na2SO4和K2SO4
D . 电路中每转移1mol电子,电极2上有32gCu析出
+4H2O
C . 2室流出的溶液中溶质为Na2SO4和K2SO4
D . 电路中每转移1mol电子,电极2上有32gCu析出
 N2O↑+2H2O,生成 11.2 L N2O 转移电子数为 2×6.02×1023
N2O↑+2H2O,生成 11.2 L N2O 转移电子数为 2×6.02×1023
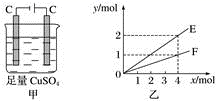
 )为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,得到广泛的研究,如图是目前研究较多的一类燃料电池工作原理示意图。
)为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,得到广泛的研究,如图是目前研究较多的一类燃料电池工作原理示意图。 
-
(1) 通入
 的电极为(填“正极”、“负极”、“阴极”或“阳极”),通入甲醇的电极反应式为。
的电极为(填“正极”、“负极”、“阴极”或“阳极”),通入甲醇的电极反应式为。
-
(2) 用甲醇燃料电池电解2L 1mol/L硫酸铜溶液,若两极共收集到气体89.6L(标准状况下)则电路中共转移个电子。
-
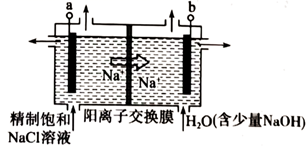
(3) 如下图所示,若用上述甲醇燃料电池做电源,石墨作电极,模拟氯碱工业。则电极a的电极反应式为;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,阳离子交换膜左侧反应室中减少的离子的物质的量为mol。
-
(1) 工业上用黄铁矿(主要成分为FeS2 , 其中硫元素为-1价)在高温条件下和氧气反应制备SO2:
 , 该反应中被氧化的元素是(填元素符号)。当收集到标准状况下二氧化硫的体积6.72L,则反应中转移电子的物质的量为。
, 该反应中被氧化的元素是(填元素符号)。当收集到标准状况下二氧化硫的体积6.72L,则反应中转移电子的物质的量为。
-
(2) 实验室中用下列装置测定SO2被催化氧化为SO3的转化率。(已知SO3的熔点为
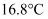 , 假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响)
, 假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响)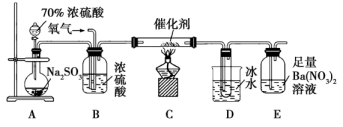
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作。
②当停止滴入浓硫酸,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是。
③实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
-
(3) 某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
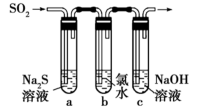
①能说明二氧化硫具有氧化性的实验现象为。
②为验证二氧化硫的还原性,反应一段时间后,取试管
 中的溶液分成三份,分别进行如下实验。
中的溶液分成三份,分别进行如下实验。方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案合理的是(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管
 中发生反应的离子方程式为。
中发生反应的离子方程式为。



