氧化还原反应的电子转移数目计算 知识点题库
25℃、101kPa下:
①2Na(s)+  O2(g)═Na2O(s)△H1=﹣414kJ/mol;
O2(g)═Na2O(s)△H1=﹣414kJ/mol;
②2Na(s)+O2(g)═Na2O2(s)△H2=﹣511kJ/mol.
下列说法正确的是( )
A . ①和②生成等物质的量的产物,转移的电子数相同
B . Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
C . 25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s)△H=+317 kJ/mol
D . ①和②产物中的阴阳离子个数比均为1:1
根据题意解答。
-
(1) KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表示为: KClO3+HCl(浓)→ KCl+ClO2↑+Cl2↑+H2O
请完成该化学方程式并配平,并标出电子转移的方向和数目.
-
(2) 浓盐酸在反应中显示出来的性质是(填写序号).
①只有还原性 ②还原性和酸性③只有氧化性 ④氧化性和酸性
-
(3) 产生0.1mol Cl2 , 则转移的电子的物质的量为 mol.
NA是阿伏加德罗常数的值,下列说法正确的是()
A . 16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B . 22.4L(标准状况)氩气含有的质子数为18NA
C . 1molFe溶于过量硝酸,电子转移数为2NA
D . 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.1NA
对于工业合成氨反应 N2(g)+3H2(g)  2NH3(g),以下分析错误的是()
2NH3(g),以下分析错误的是()
A . 在5L固定容积的密闭容器内,前2分钟消耗2molN2 , 则v(N2)=0.2mol·L-1·min-1
B . 改变条件可使H2的转化率达100%
C . 每消耗3molH2 , 必然生成2molNH3
D . 合成氨是人类科学史上的一项重大突破,缓解了粮食不足问题
在溶液中0.2 mol X2O72-恰好能使0.6 mol SO32-被完全氧化,则X2O72-被还原后X元素的化合价为( )
A . +1
B . +2
C . +3
D . +4
由U形管质量为mg的铁棒、质量为mg的碳棒和1L0.2mol· L-1CuCl2溶液组成如图所示装置,下列说法不正确的是( )
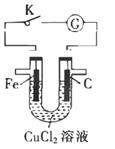
A . 打开K,铁棒上有紫红色物质析出
B . 闭合K,碳棒上有紫红色固体析出
C . 闭合K,碳棒表面发生的电极反应为Fe2++2e-=Fe
D . 闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差18g
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B . 0.5molAl与足量盐酸反应转移电子数为NA
C . 46gNO2和N2O4的混合物含有的分子数为NA
D . 同温同体积时,两种气体的压强比等于物质的量之比
已知铅(Pb)与硅同主族且Pb比Si多3个电子层。
-
(1) 难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4 , 说明(CH3COO)2Pb是(填“强”或“弱”)电解质。
-
(2) 将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移mol电子。
-
(3) 在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成两种无污染的气体,该反应的化学方程式为:。
-
(4) ①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,溶液变蓝色,且反应后溶液呈碱性,发生反应的离子方程式是。
②在上述碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,写出发生反应的离子方程式是。
-
(5) 处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+ , 再用氨水将Cr3+转变为难溶的Cr(OH)3 , 在该过程中氧化剂为,其中氨水转化Cr3+为Cr(OH)3的离子方程式为;该方案处理后的废水中因含有大量元素,直接排放会导致水体富营养化。
将38.4gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成含NaNO2和NaNO3的盐溶液。则生成的盐溶液中NaNO3的物质的量为( )
A . 0.2mol
B . 0.4mol
C . 0.6mol
D . 0.8mol
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 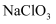 的混合液,经测定溶液中
的混合液,经测定溶液中 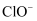 与
与 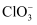 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 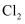 的分子个数比为( )
的分子个数比为( )
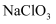 的混合液,经测定溶液中
的混合液,经测定溶液中 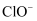 与
与 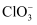 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 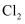 的分子个数比为( )
的分子个数比为( )
A . 21:5
B . 11:3
C . 5:1
D . 3:1
《Nature》期刊曾报道一例CH3OH-O2在聚合物催化下的原电池,其工作示意图如下图所示。下列说法正确的是( )
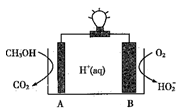
A . 电极A是负极,发生还原反应
B . 电解质溶液中H+由电极B流向电极A
C . 电极B的电极反应式:  D . 外电路中通过0.3 mol电子,A电极生成CO2的质量为6.6 g
D . 外电路中通过0.3 mol电子,A电极生成CO2的质量为6.6 g
 D . 外电路中通过0.3 mol电子,A电极生成CO2的质量为6.6 g
D . 外电路中通过0.3 mol电子,A电极生成CO2的质量为6.6 g
化学需氧量(COD)是衡量水质的重要指标之一。COD 是指在特定条件下用一种强氧化 剂(如 KMnO4)定量地氧化水体中的还原性物质所消耗的氧化剂的量(折算为氧化能力相当的O2 质量,单位:mg·L-1)。其测定过程如下: 取 100.0mL 水样,用硫酸酸化,加入 10.0 mL 0.002000mol·L-1 KMnO4溶液,充分作用后,再加入 10.0mL 0.005000mol·L-1  溶液。用 0.002000mol·L-1 KMnO4溶液滴定,滴定终点时消耗 6.50mL。
溶液。用 0.002000mol·L-1 KMnO4溶液滴定,滴定终点时消耗 6.50mL。
 溶液。用 0.002000mol·L-1 KMnO4溶液滴定,滴定终点时消耗 6.50mL。
溶液。用 0.002000mol·L-1 KMnO4溶液滴定,滴定终点时消耗 6.50mL。 已知:2MnO  +5
+5  +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
-
(1) 1 mol KMnO4 的氧化能力与g O2 的氧化能力相当(作氧化剂时转移的电子数相同)。
-
(2) 该水样的 COD 值是mg·L-1 (保留小数点后一位)。
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 11.2 LCl2通入足量的NaOH 溶液中充分反应 ,转移的电子数为 0.5NA
B . 4.4 g 由 CO2 和 N2O 组成的混合气体中含有的电子总数为 2.2NA
C . 常温下 ,1.0L p H=1 的 H2SO4溶液中含有H+的数目为 0.2NA
D . 11.5 g乙醇分子中含有C- H键的数目为1.5NA
 、
、  、
、  、
、  、
、 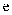 为原子序数依次增大的短周期元素,其中只有一种是金属元素。
为原子序数依次增大的短周期元素,其中只有一种是金属元素。  、
、 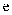 元素原子最外层电子数相同,且
元素原子最外层电子数相同,且  和
和 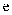 可形成离子化合物,
可形成离子化合物,  和
和  具有相同的电子数,
具有相同的电子数,  元素的最高正化合价与最低负化合价之和为2。化学式为
元素的最高正化合价与最低负化合价之和为2。化学式为  的化合物熔点高,可作超硬耐磨材料。下列说法错误的是。( )
的化合物熔点高,可作超硬耐磨材料。下列说法错误的是。( )
A . 原子半径的大小关系: 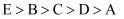 B .
B .  ,
,  的最高价含氧酸的酸性强弱:
的最高价含氧酸的酸性强弱:  C .
C .  ,
,  可形成具有强氧化性的
可形成具有强氧化性的 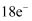 微粒
D .
微粒
D . 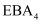 具有强还原性,与足量水反应时每产生
具有强还原性,与足量水反应时每产生  气体转移
气体转移  个电子
个电子
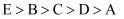 B .
B .  ,
,  的最高价含氧酸的酸性强弱:
的最高价含氧酸的酸性强弱:  C .
C .  ,
, 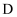 可形成具有强氧化性的
可形成具有强氧化性的 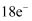 微粒
D .
微粒
D . 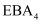 具有强还原性,与足量水反应时每产生
具有强还原性,与足量水反应时每产生  气体转移
气体转移  个电子
个电子
一定条件下,NaClO(Cl为+1价)与Fe(OH)3恰好完全反应,反应后Cl元素全部转移到NaCl中。已知NaClO与Fe(OH)3反应的化学计量数之比为3∶2,则Fe(OH)3中的Fe元素可能完全转化为( )
A . Fe
B . Fe2+
C . Fe3+
D . FeO 

回答下列问题:
-
(1) 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。“三酸”与“两碱”之间均可反应,请用离子方程式表示硫酸与烧碱和纯碱的反应:、。
-
(2) 实验室制取NO的反应如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。用双线桥法表示出电子转移的方向和数目,还原产物是,反应的离子方程式是,硝酸在反应中体现。
a.还原性 b.还原性和酸性 c.氧化性 d.氧化性和酸性
-
(3) 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:2KNO3+3C+S
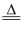 K2S+N2↑+3CO2↑该反应中,写出上述反应生成物中,属于非电解质的物质是,属于电解质的物质是,氧化产物是。
K2S+N2↑+3CO2↑该反应中,写出上述反应生成物中,属于非电解质的物质是,属于电解质的物质是,氧化产物是。
 是阿伏加德罗常数的值,下列说法正确的是( )
是阿伏加德罗常数的值,下列说法正确的是( )
A . 22.4L(标准状况)氮气中含有7 NA个电子
B . 0.1  磷酸钠溶液含有的
磷酸钠溶液含有的  数目为0.3 NA个
C . 1mol
数目为0.3 NA个
C . 1mol  被还原为
被还原为  ,转移的电子数为3 NA个
D . 16g氧气和臭氧的混合气体中含有NA个氧原子
,转移的电子数为3 NA个
D . 16g氧气和臭氧的混合气体中含有NA个氧原子
 磷酸钠溶液含有的
磷酸钠溶液含有的  数目为0.3 NA个
C . 1mol
数目为0.3 NA个
C . 1mol  被还原为
被还原为  ,转移的电子数为3 NA个
D . 16g氧气和臭氧的混合气体中含有NA个氧原子
,转移的电子数为3 NA个
D . 16g氧气和臭氧的混合气体中含有NA个氧原子
高铁酸钠( )具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成
)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成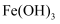 能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:
能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下: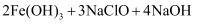
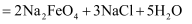 。下列说法错误的是( )
。下列说法错误的是( )
 )具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成
)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成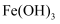 能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:
能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下: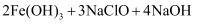
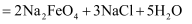 。下列说法错误的是( )
。下列说法错误的是( )
A .  中
中 元素显+6价
B . 碱性条件下
元素显+6价
B . 碱性条件下 氧化性强于
氧化性强于 C . 每生成
C . 每生成 转移
转移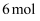 电子
D . 在水处理中,
电子
D . 在水处理中, 兼具消毒和净水两种功能
兼具消毒和净水两种功能
 中
中 元素显+6价
B . 碱性条件下
元素显+6价
B . 碱性条件下 氧化性强于
氧化性强于 C . 每生成
C . 每生成 转移
转移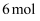 电子
D . 在水处理中,
电子
D . 在水处理中, 兼具消毒和净水两种功能
兼具消毒和净水两种功能
硫及其化合物的“价一类”二维图如下所示。
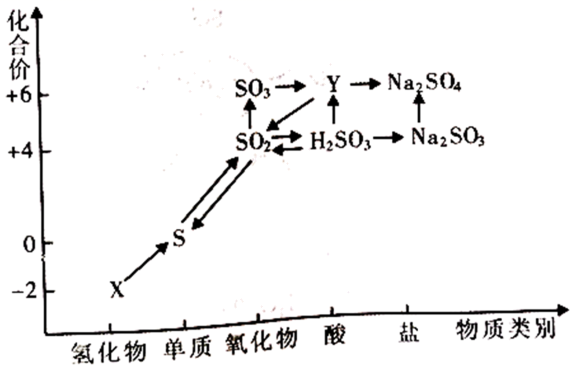
下列说法不正确的是( )
A . 由X生成S,必须加入氧化剂
B . 从物质类别角度分析, 和
和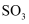 都属于酸性氧化物
C . 在加热情况下,y的浓溶液与铜单质可以发生化学反应生成
都属于酸性氧化物
C . 在加热情况下,y的浓溶液与铜单质可以发生化学反应生成 D . 24mL0.05
D . 24mL0.05 的
的 溶液与20mL0.02
溶液与20mL0.02 的
的 溶液恰好反应,已知
溶液恰好反应,已知 转化为
转化为 , 则Cr元素在还原产物中的化合价为+3
, 则Cr元素在还原产物中的化合价为+3
 和
和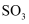 都属于酸性氧化物
C . 在加热情况下,y的浓溶液与铜单质可以发生化学反应生成
都属于酸性氧化物
C . 在加热情况下,y的浓溶液与铜单质可以发生化学反应生成 D . 24mL0.05
D . 24mL0.05 的
的 溶液与20mL0.02
溶液与20mL0.02 的
的 溶液恰好反应,已知
溶液恰好反应,已知 转化为
转化为 , 则Cr元素在还原产物中的化合价为+3
, 则Cr元素在还原产物中的化合价为+3
以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O2 2Cu+SO2。下列说法错误的是( )
2Cu+SO2。下列说法错误的是( )
 2Cu+SO2。下列说法错误的是( )
2Cu+SO2。下列说法错误的是( )
A . 化合价发生变化的元素有3种
B . Cu2S在该反应中既是氧化剂又是还原剂
C . 1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D . SO2被分离、回收后氧化生成SO3 , 作为制取硫酸的原料
最近更新



