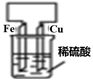
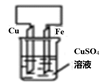
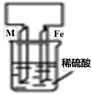
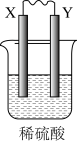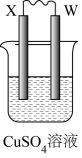常见金属的活动性顺序及其应用 知识点题库
下列化学方程式中,不正确的是
A . Cu+2HCl =CuCl2+H2↑
B . Fe+CuSO4 =FeSO4+Cu
C . Al2O3+2NaOH =2NaAlO2+H2O
D . 2Al+Fe2O3 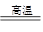 2Fe+Al2O3
2Fe+Al2O3
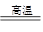 2Fe+Al2O3
2Fe+Al2O3
下列解释物质用途或现象的反应方程式不正确的是( )
A . 汽车尾气中发生的催化转化反应:2NO+2CO  N2+2CO2
B . 铝热反应用于焊接钢轨:2Al+Fe2O3
N2+2CO2
B . 铝热反应用于焊接钢轨:2Al+Fe2O3  Al2O3+2Fe
C . 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2
Al2O3+2Fe
C . 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2  2CaSO3+2CO2
D . 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO
2CaSO3+2CO2
D . 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO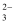 ═CaCO3+SO
═CaCO3+SO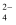
 N2+2CO2
B . 铝热反应用于焊接钢轨:2Al+Fe2O3
N2+2CO2
B . 铝热反应用于焊接钢轨:2Al+Fe2O3  Al2O3+2Fe
C . 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2
Al2O3+2Fe
C . 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2  2CaSO3+2CO2
D . 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO
2CaSO3+2CO2
D . 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CO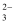 ═CaCO3+SO
═CaCO3+SO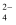
有A,B,C,D四种金属,将A与B用导线连结起来,浸入电解质溶液中,A易腐蚀.将A,D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A . D>A>B>C
B . A>D>B>C
C . D>A>C>B
D . C>B>A>D
有M,N,P,Q四块金属片,进行如下实验,
①M,N用导线相连后,同时插入稀H2SO4中,M极为负极
②P,Q用导线相连后,同时浸入稀H2SO4中,电子由P→导线→Q
③M,P相连后,同时浸入稀H2SO4 , P极产生大量气泡
④N,Q相连后,同时浸入稀H2SO4中,Q极发生氧化反应,
则四种金属的活动性顺序为( )
A . M>N>P>Q
B . P>M>N>Q
C . N>Q>P>M
D . M>P>Q>N
有甲、乙、丙、丁四种金属,将它们分别投入到相同的稀盐酸中,只有丙、丁的表面有气泡产生,且丙产生的气泡比丁快;再将乙投入到甲的盐酸液中,乙的表面有甲析出.则四种金属的活动性顺序正确的是( )
A . 甲>乙>丙>丁
B . 丙>丁>乙>甲
C . 丙>丁>甲>乙
D . 无法判断
有甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在;丙盐的水溶液不能用丁制的容器盛放;丁与乙盐的水溶液不反应.则这四种金属的活动性由强到弱的顺序可能是( )
A . 甲乙丙丁
B . 丁乙丙甲
C . 丙乙丁甲
D . 乙丁丙甲
把a、b、c、d四块金属浸入稀硫酸溶液中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,d上有气泡逸出; a、c相连时,a极质量减轻;b、d相连时,b为正极.据此,判断四种金属的活动性顺序是( )
A . a>b>c>d
B . a>c>b>d
C . a>c>d>b
D . b>d>c>a
下列反应最终无沉淀产生的是( )
A . 过量的CO2通入Na2SiO3溶液中
B . 向AlCl3溶液中滴加稀氨水至过量
C . 少量的CO2通入BaCl2溶液中
D . 向FeCl3溶液中滴加NaOH溶液至过量
A、B、C三种金属,A中混有C时A先腐蚀,A与B组成原电池,A为电池正极,则A、B、C三种金属的活动性顺序为( )
A . A>B>C
B . A>C>B
C . B>A>C
D . B>C>A
将4种金属分别加入到4支装有稀盐酸的试管中,记录的现象如下表所示,正确的是( )
| 选项 | 加入的金属 | 是否有气体产生 |
| A | 铜 | 有 |
| B | 铁 | 有 |
| C | 铝 | 无 |
| D | 镁 | 无 |
A . A
B . B
C . C
D . D
将少量的A、B两份锌粉装入试管中,分别加入足量的等浓度、等体积的稀硫酸中,同时向装A的试管中加入少量CuSO4溶液。如下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A . 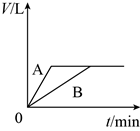 B .
B . 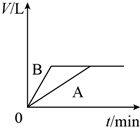 C .
C . 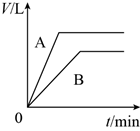 D .
D . 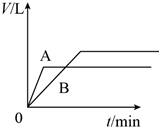
 B .
B .  C .
C .  D .
D . 
下列叙述正确的是( )
A . Li、Na、K、Rb四种单质中,Rb的熔点最高
B . 氯化钙的电子式为 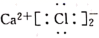 C . 离子化合物一定只含离子键
D . HF的热稳定性强于HCl,说明非金属性:F>Cl
C . 离子化合物一定只含离子键
D . HF的热稳定性强于HCl,说明非金属性:F>Cl
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体中有铁存在,则反应后溶液中存在较多的阳离子是( )
A . Cu2+
B . Fe3+
C . Fe2+
D . H+
下列叙述中不正确的是( )
A . 可逆反应设计成双液电池,当反应达平衡时,外电路上没有电流通过
B . 将 NO2、N2O4 平衡混合气体的体积压缩为原来的一半,新平衡后气体颜色加深
C . 利用盖斯定律,可以计算某些难以直接测量的反应焓变
D . 抗腐蚀的金属一定排在金属活动性顺序表氢元素之后
实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
|
序号 |
甲 |
乙 |
丙 |
|
装置 |
| | |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
-
(1) 装置甲中铁极的电极反应式是,溶液中H+向极移动(填“正”或“负”)。
-
(2) 装置乙中铜极发生(填“氧化”或“还原”)反应。
-
(3) 装置丙中M极为(填“正极”或“负极”),一段时间后溶液的酸性(填“增强”“减弱”或“不变”)。
-
(4) Fe、Cu、M中金属活动性最强的是。
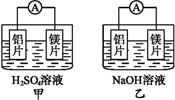
有甲、乙两位同学均想利用原电池反应检测金属的活动性强弱,两人均使用镁片与铝片作电极,但甲同学将电极放入6
mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示:
-
(1) 写出甲池中负极的电极反应式: 。
-
(2) 写出乙池中负极的电极材料和总反应的离子方程式:负极材料(化学式);总反应的离子方程式。
-
(3) 由此实验,可得到如下哪些正确结论________(填字母)。A . 利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B . 镁的金属性不一定比铝的金属性强 C . 该实验说明金属活动性顺序已过时,已没有实用价值 D . 该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
-
(4) 丙同学依据甲、乙同学的思路,设计如下实验:
将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池,在这两个原电池中,负极分别为__________(填字母)。
A . 铝片、铜片 B . 铜片、铝片 C . 铝片、铝片 D . 铜片、铜片
把a、b、c、d四种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a,b相连,a为负极;c、d相连,d上有气泡溢出;a,c相连,a质量减少;b,d相连,b为正极。则四种金属的活动性顺序由大到小为( )
A . 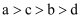 B .
B . 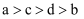 C .
C . 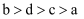 D .
D . 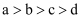
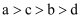 B .
B . 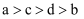 C .
C . 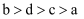 D .
D . 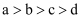
“类推”这种思维方法在化学学习与研究中有时会产生不符合题意结论,因此类推的结论最终要经过实践的检验,才能决定其符合题意与否。下列类推结论中正确的是( )
A . Fe从CuSO4溶液中置换出Cu;Na从FeCl3溶液中置换出Fe
B . Ca(ClO)2溶液中通入适量CO2恰好反应,所得溶液具有漂白性;Ca(ClO)2溶液中通入适量SO2恰好反应,所得溶液也具有漂白性
C . Fe与Cl2反应生成FeCl3;Fe与I2反应生成FeI3
D . Cu(OH)2受热分解生成CuO;Fe(OH)3受热也易分解生成Fe2O3
下列叙述Ⅰ和Ⅱ均正确且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| B | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | CaCO3难溶于水 | CO2通入CaCl2溶液中产生白色沉淀 |
A . A
B . B
C . C
D . D
某同学利用下表中的装置图就可以确定X、Y、Z、W四种金属的活泼性顺序。
编号 | 甲 | 乙 | 丙 |
装置 |
|
|
|
现象 | X电极慢慢变细 | X电极上有红色物质出现 | 某电极上有气泡产生 |
-
(1) 装置甲外电路中电子的流动方向是(填“由X电极流向Y电极”或“由Y电极流向X电极”),一段时间后发现烧杯中溶液的温度略有上升,则烧杯中能量的转化形式为。
-
(2) 装置乙中正极的电极反应式是,当有6.4g红色物质生成时,外电路中转移的电子数目是NA。
-
(3) 请选用适当的材料构成装置丙的原电池,相应的电极材料可以是(填字母),选用的电解质溶液可以是(电解质溶液不能使用图中已用过的)。
最近更新