常见金属的活动性顺序及其应用 知识点题库
(2)向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为 .
(3)现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是 .
①20mL 0.01mol•L﹣1 KCl溶液
②30mL 0.02mol•L﹣1 CaCl2溶液
③40mL 0.03mol•L﹣1 HCl溶液
④10mL蒸馏水
⑤50mL 0.05mol•L﹣1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.此电池的负极发生的电极反应式是 ;
(5)某酸H2B在水溶液中有如下变化:H2B═H++HB﹣;HB﹣⇌H++B2﹣;现有溶液0.10mol/L、100mL,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol•L﹣1 NaHB溶液的pH=2,则0.1mol•L﹣1 H2B溶液中氢离子的物质的量浓度可能是 (填“<”,“>”,或“=”).
①用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中.聚乙烯的结构简式是 .
②不法商贩会用由铜锌合金打造的假金首饰欺骗消费者.请写出检验金首饰真假的化学方法和结论
③许多城市禁放烟花爆竹.制作烟花爆竹的黑火药用木炭、硝酸钾、硫磺配制,黑火药爆炸时会生成氮气、硫化钾和二氧化碳.写出该反应的化学方程式
-
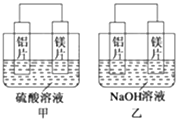
(1) 写出甲中正极的电极反应式.
-
(2) 乙中总反应的离子方程式:.
-
(3) 如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出活动性更强,而乙会判断出活动性更强.(填写元素符号)
-
(4) 由此实验得出的下列结论中,正确的有.
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析.
-
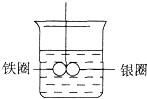
(1) 片刻后可观察到的现象是(指悬吊的金属圈) .A . 铁圈和银圈左右摇摆不定 B . 保持平衡状态不变 C . 铁圈向下倾斜 D . 银圈向下倾斜
-
(2) 产生上述现象的原因是.
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2 , H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H
-
(1) 甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成。
-
(2) 乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:。
-
(3) 丙同学对臭味气体的成分提出三种假设。
【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是;
假设3:产生臭味的气体是。
-
(4) 【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。
请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作
预期现象
结论
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用、在短时间内快速检测产生的气体。
假设1成立
假设2成立
假设3成立
① X + Y(NO3)2 = X(NO3)2 + Y
② X 与H2SO4(稀)不反应
③ M + H2SO4(稀) =MSO4 + H2↑
④ N + MSO4 = NSO4 + M

-
(1) 按如图所示操作,充分反应后:
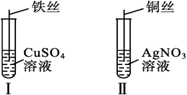
①Ⅰ中发生反应的离子方程式为;
②Ⅱ中铜丝上观察到的现象是;
③结合Ⅰ、Ⅱ的实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为。
-
(2) 将少量Cl2通入FeBr2溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;将足量Cl2通入FeBr2溶液中,反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2。这个事实说明具有还原性的粒子的还原性强弱顺序为。
 B .
B .  C .
C .  D .
D . 
| 已知事实 | 类推结论 | |
| A | 将Zn加入CuSO溶液中:Zn+Cu2+=Cu+Zn2+ | 将Na加入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
| B | 将FeO加入稀盐酸溶液中:FeO+2H+=Fe2++H2O | 将FeO加入稀硝酸溶液中:FeO+2H+=Fe2++H2O |
| C | 电解NaCl冶炼金属钠:2NaCl(熔融) | 电解AlCl3冶炼金属铝:2AlCl3(熔融) |
| D | Cl2与SO2的水溶液反应:Cl2+2H2O+SO2=2HCl+H2SO4 | Br2与SO2的水溶液反应:Br2+2H2O+SO2=2HBr+H2SO4 |
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 石墨能导电且化学性质不活泼 | 外加电流法保护金属可用石墨作辅助阳极 |
| B | 氢氟酸是挥发性弱酸 | 氢氟酸可用于刻蚀玻璃器皿 |
| C | 铁的金属性比铜强 | |
| D | | |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向酸性 | 溶液紫色褪去 | |
| B | 将常温下用冷的浓硝酸处理过的铝片插入硫酸铜溶液中 | 铝片表面无明显现象 | 用硝酸处理后,铝的金属性减弱 |
| C | 向试管中加入5mL10% | 试管内产生砖红色沉淀 | 葡萄糖分子中含有醛基 |
| D | 向新制氯水中加入足量碳酸钙固体,然后用玻璃棒蘸取溶液于pH试纸上 | 氯水颜色变浅,pH试纸颜色褪去 | 加入碳酸钙后,氯水中的HCl被消耗,平衡 |
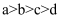 B .
B .  C .
C . 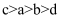 D .
D . 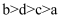
 溶液可用于铜质印刷电路板的制作
溶液可用于铜质印刷电路板的制作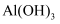 难溶于水
难溶于水 溶液中通入
溶液中通入 
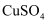 溶液,然后滴加5滴5%NaOH溶液,再向所得悬浊液中滴加葡萄糖溶液,加热煮沸
溶液,然后滴加5滴5%NaOH溶液,再向所得悬浊液中滴加葡萄糖溶液,加热煮沸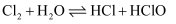 向右移动,HClO浓度增大,且HClO具有漂白性
向右移动,HClO浓度增大,且HClO具有漂白性


