铁的氧化物和氢氧化物 知识点题库
,反应后得到的FeCl3溶液呈棕黄色,用此溶液进行以下实验:
(1)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3 溶液,继续煮沸至溶液成红褐色,停止加热,制得的分分散系中分散质粒子直径大小为.
(2)向(2)中烧杯中的分散系中逐滴滴入过量盐酸,会再出现一系列变化:
①先出现红褐色沉淀,原因是 .
②随后沉淀逐渐溶解,溶液呈棕黄色,反应的离子方程式为 .
-
(1) 常作为潜水艇和呼吸面具中氧气的淡黄色固体是;
-
(2) 常用于焙制糕点,也可用作抗酸药的是;
-
(3) 属于两性氧化物的是;
-
(4) 属于红棕色固体是.
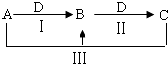
-
(1) 若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是.
②反应Ⅲ的离子方程式是.
③氯碱工业制备A的化学方程式是,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是.
-
(2) 若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是.
②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是.
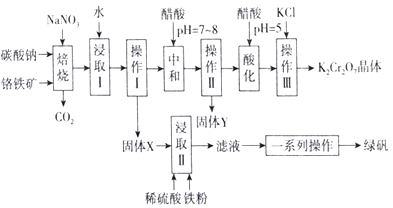
已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+ 4CO2 ↑+7NaNO2。
-
(1) 绿矾的化学式为。
-
(2) 焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为。
-
(3) 固体Y的主要成分为(填写化学式)。
-
(4) 酸化过程中用醋酸调节pH=5的目的为;若pH调节的过低,NO2-可被氧化为NO3- , 其离子方程式为。
-
(5) 调节pH=5后,加入KCl 控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7Na2Cr2O7(填“大于”或“小于”)。
-
(6) 流程中的一系列操作为。
 HClO(aq)
HClO(aq)  HCl(aq)
B . H2SiO3
HCl(aq)
B . H2SiO3  SiO2
SiO2  SiCl4
C . Al
SiCl4
C . Al  Al(OH)3
Al(OH)3  Al2O3
D . Fe2O3
Al2O3
D . Fe2O3  Fe(OH)3
Fe(OH)3  Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
-
(1) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为: ,用硫酸亚铁晶体配制FeSO4溶液时你觉得还需加入少量的,防止FeSO4被氧化。
-
(2) 向FeCl3溶液中滴加KSCN溶液,溶液呈色。
-
(3) 某气态氧化物化学式为RO2 , 在标准状况下,0.92g该氧化物的体积是448mL,则氧化物的相对分子质量为,R的摩尔质量为。
-
(4) 48g SO42-中含有的电子数为。
-
(5) NaClO2+4HCl(浓)
 NaCl+2Cl2↑+2H2O,此反应的氧化产物与还原产物的物质的量之比是,生成标准状况下4.48 L Cl2时,转移的电子数为。
NaCl+2Cl2↑+2H2O,此反应的氧化产物与还原产物的物质的量之比是,生成标准状况下4.48 L Cl2时,转移的电子数为。
| A | B | C | D |
| 氧化铁 | 带玻璃塞的试剂瓶 | 铁罐车 | 铝制饭盒 |
| 可用作红色颜料 | 可用于盛放 氢氧化钠溶液 | 可用于运输浓硫酸 | 不宜长时间存放酸性或碱性的食物 |
-
(1) 司南是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
-
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
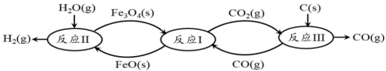
①已知:Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g)ΔH1=+19.3kJ·mol-1
3FeO(s)+CO2(g)ΔH1=+19.3kJ·mol-13FeO(s)+H2O(g)
 Fe3O4(s)+H2(g)ΔH2=-57.2kJ·mol-1
Fe3O4(s)+H2(g)ΔH2=-57.2kJ·mol-1C(s)+CO2(g)
 2CO(g)ΔH3=+172.4kJ·mol-1
2CO(g)ΔH3=+172.4kJ·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是。
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
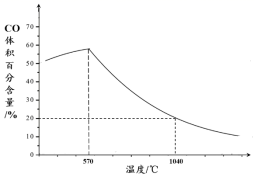
i.反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g)ΔH0(填“>”、“<”或“=”),理由是。
3Fe(s)+4CO2(g)ΔH0(填“>”、“<”或“=”),理由是。ii.随温度升高,反应Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g)平衡常数的变化趋势是;1040℃时,该反应的化学平衡常数的数值是。
3FeO(s)+CO2(g)平衡常数的变化趋势是;1040℃时,该反应的化学平衡常数的数值是。 -
(3) ①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中CN- , 方案如下:
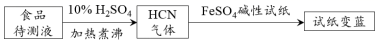
若试纸变蓝则证明食品中含有CN- , 请解释检测时试纸中FeSO4的作用。
![]()
-
(1) 写出FeCl3溶液与铜箔发生反应的离子方程式:。
-
(2) 检验废腐蚀液中是否含有Fe3+所需试剂名称:,实验现象:。
-
(3) 向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:,此转化的化学方程式为:。
-
(4) 写出③中所含物质:,⑥发生反应的离子方程式:。
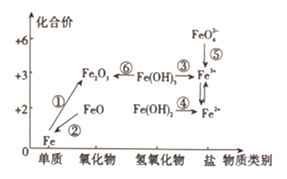
 )可用于饮用水的消毒,由此可预测,高铁酸盐(FeO
)可用于饮用水的消毒,由此可预测,高铁酸盐(FeO  )具有强氧化性
D . 铁在氧气中燃烧可实现上述①的转化
)具有强氧化性
D . 铁在氧气中燃烧可实现上述①的转化







