铁的氧化物和氢氧化物 知识点题库
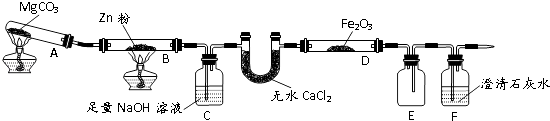
-
(1) MgCO3的分解产物为.
-
(2) 装置C的作用是,处理尾气的方法为.
-
(3) 将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
步骤
操作
甲组现象
乙组现象
1
取黑色粉末加入稀盐酸
溶解,无气泡
溶解,有气泡
2
取步骤1中溶液,滴加K3[Fe(CN)6]溶液
蓝色沉淀
蓝色沉淀
3
取步骤1中溶液,滴加KSCN溶液
变红
无现象
4
向步骤3溶液中滴加新制氯水
红色褪去
先变红,后褪色
①乙组得到的黑色粉末是.
②甲组步骤1中反应的离子方程式为.
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为.
①FeS2 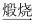 SO3
SO3  H2SO4
H2SO4
②Al2O3 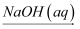 NaAlO2(aq)
NaAlO2(aq) 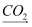 Al(OH)3
Al(OH)3
③NaCl(aq)  Na
Na  Na2O2
Na2O2
④Fe  FeSO4(aq)
FeSO4(aq) 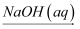 Fe(OH)2
Fe(OH)2 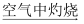 Fe2O3
Fe2O3
⑤海水 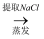 母液
母液  粗溴
粗溴 

 Br2 .
Br2 .

-
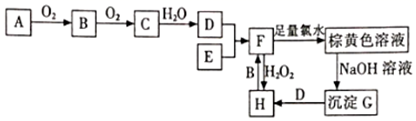
(1) 写出A、C、F、G的化学式:A;C;F;G。
-
(2) 保存C溶液时要加固体A的原因是。
-
(3) 写出下列转化的离子方程式。
①D→C:;
②C→D:;
③B→C+D。
-
(4) 写出E→F的化学方程式:。
 +H+=CO2+H2O↑
B . 铁锈溶于稀硫酸:Fe2O3+6H+=2Fe3++3H2O
C . 铝溶于氢氧化钠溶液:Al+OH-+H2O=AlO
+H+=CO2+H2O↑
B . 铁锈溶于稀硫酸:Fe2O3+6H+=2Fe3++3H2O
C . 铝溶于氢氧化钠溶液:Al+OH-+H2O=AlO  +H2↑
D . 0.1mol•L-1的NaAlO2溶液和0.15mol•L-1的H2SO4溶液等体积混合:AlO
+H2↑
D . 0.1mol•L-1的NaAlO2溶液和0.15mol•L-1的H2SO4溶液等体积混合:AlO  +4H+=Al3++2H2O
+4H+=Al3++2H2O
I.称取144.6g样品,灼烧至恒重时(假如只失去结晶水,不发生其他反应),得蒸馏水的质量为64.8g。
II.将上述剩余固体完全溶于水,并将所得溶液分成三等份:
①往其中一份中加入足量的 NaOH 浓溶液并加热,最终得到标准状况下2.24L气体。
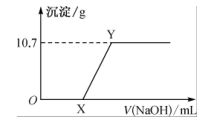
②往第二份中加入稀硫酸,然后向此混合溶液中逐滴加入0.1mol·L-1 NaOH 溶液,滴加过程中产生红褐色沉淀的质量与加入 NaOH 溶液的体积的关系如图所示:
③往第三份中加入足量的0.1mol·L-1 BaCl2溶液,生成不溶于稀硝酸的白色沉淀46.6g
回答下列问题:
-
(1) 操作①中生成气体的离子方程式为。
-
(2) 操作②中OX段反应的离子方程式为 ;XY 段反应的离子方程式为 。
-
(3) 操作③中生成的沉淀为 ,其物质的量为。
-
(4) 铁铵矾的化学式为 。
请完成下列问题:
-
(1) 沉淀G的化学式;
-
(2) 棕黄色溶液中的金属阳离子若浓度很小最好用溶液检验;
-
(3) 写出B转化为C的化学方程式:;
-
(4) 写出H与B反应的离子方程式:。
 +H+=CO2↑+H2O
B . 钠放入硫酸铜溶液中:2Na+Cu=2Na++Cu2+
C . 金属铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+
D . 磁性氧化铁溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
+H+=CO2↑+H2O
B . 钠放入硫酸铜溶液中:2Na+Cu=2Na++Cu2+
C . 金属铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+
D . 磁性氧化铁溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 将湿润的有色布条放入充满氯气的集气瓶中 | 布条褪色 | 氯气具有漂白性 |
| B | 在 CO 还原 Fe3O4 得到的黑色固体中加入盐酸,固体溶解,再加入 KSCN 溶液 | 溶液不显血红色 | 黑色固体一定是 Fe |
| C | 向 BaCl2 溶液中通入适量 CO2 | 产生白色沉淀 | 白色沉淀为 BaCO3 |
| D | 向包有 Na2O2粉末的脱脂棉中滴几滴水 | 脱脂棉剧烈燃烧 | Na2O2 与水反应放热 |
-
(1) 取少量
 (红棕色)粉末加入适量盐酸,所发生反应的离子方程式是。反应后得到的
(红棕色)粉末加入适量盐酸,所发生反应的离子方程式是。反应后得到的  溶液呈棕黄色。
溶液呈棕黄色。
-
(2) 在小烧杯甲中加入
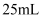 蒸馏水,加热至沸腾后,向沸水中加入
蒸馏水,加热至沸腾后,向沸水中加入 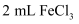 溶液,继续煮沸至溶液呈色,即可制得
溶液,继续煮沸至溶液呈色,即可制得 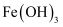 胶体。取
胶体。取 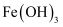 胶体于烧杯中,用红色激光笔照射烧杯中的液体,可看到烧杯中产生效应。所得分散系与原
胶体于烧杯中,用红色激光笔照射烧杯中的液体,可看到烧杯中产生效应。所得分散系与原  溶液是不同的分散系,其本质原因是不同。
溶液是不同的分散系,其本质原因是不同。
-
(3) 在制得的红褐色液体中逐滴加入稀硫酸,看到的现象为,写出与现象有关的离子反应方程式。
-
(4) 在胶体中加入电解质溶液或带有相反电荷的胶体微粒能使胶体微粒沉淀下来。将
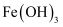 胶体装入
胶体装入  形管内,用石墨做电极,接通直流电,通电一段时间后发现与电源负极相连的电极区附近颜色逐渐加深,这表明
形管内,用石墨做电极,接通直流电,通电一段时间后发现与电源负极相连的电极区附近颜色逐渐加深,这表明 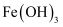 胶体微粒带(填“正”或“负”)电荷。
胶体微粒带(填“正”或“负”)电荷。
-
(5) 如
 溶液中含有少量的
溶液中含有少量的  ,要除去
,要除去  得到纯净的
得到纯净的  溶液,有下列实验方案:
溶液,有下列实验方案: 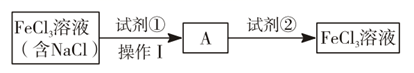
试剂②是(填化学式);“操作Ⅰ”为(填操作名称)。
 B . 铁生锈后表面有一层致密的氧化膜
B . 铁生锈后表面有一层致密的氧化膜 C . 打印机使用的墨粉中添加了铁的磁性氧化物
C . 打印机使用的墨粉中添加了铁的磁性氧化物 D . 用
D . 用 溶液作为“腐蚀液”,刻制印刷电路板生成
溶液作为“腐蚀液”,刻制印刷电路板生成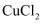 和Fe
和Fe
①重晶石
②
③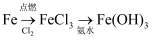
④




