制取氢氧化铁、氢氧化亚铁 知识点题库
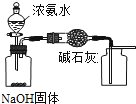 B . 用装置制备Fe(OH)2并能较长时间观察其颜色
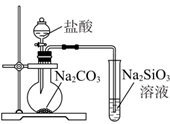
B . 用装置制备Fe(OH)2并能较长时间观察其颜色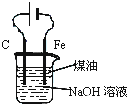 C . 装置可证明非金属性Cl>C>Si
C . 装置可证明非金属性Cl>C>Si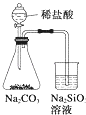 D . 装置向左推动针筒活塞可检验该装置的气密性
D . 装置向左推动针筒活塞可检验该装置的气密性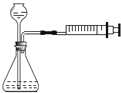
方法一:用不含的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应来制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 . 发生反应的离子方程式:
(2)除去蒸馏水中溶解的O2常采用 的方法.
(3)生成白色Fe(OH)沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液的液面下,再挤出NaOH溶液.这样操作的理由是
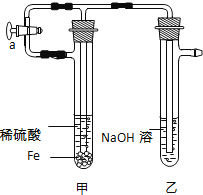
方法二:在如图的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备.
(1)在试管Ⅰ里加入的试剂是 .(2)在试管Ⅱ里加入的试剂是 .
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 .

(1)将实验所需的稀硫酸和氢氧化钠溶液加热煮沸,其目的是 .
(2)按图所示连接好装置,打开止水夹a,反应片刻后,夹紧止水夹a,此时可观察到的现象是 ;乙中发生反应的离子方程式是 .
(3)将试管乙中的混合物倒入表面皿中,可观察到的现象 ;反应的化学方程式是 .
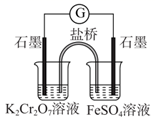
 比较Cl2、Fe3+、I2的氧化性
B .
比较Cl2、Fe3+、I2的氧化性
B . 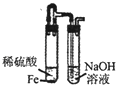 制取Fe(OH)2
C .
制取Fe(OH)2
C . 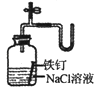 证明铁生锈时空气参加反应
D .
证明铁生锈时空气参加反应
D .  检查装置气密性
检查装置气密性
①取少量甲的品体溶于蒸馏水配成溶液:
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热:
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
-
(1) C的元素符号是,D在周期表中的位置。
-
(2) 用离子方程式表示实验②中现象的原因:。
-
(3) 实验③中出现的现象是。
-
(4) 经测定甲晶体(结晶水合物)的摩尔质量为392g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为。
①SiO2 ②H2SiO3 ③Al(OH)3 ④Fe(OH)3 ⑤FeCl2
 B . 制取氨气
B . 制取氨气 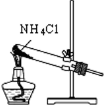 C . 分离碘和酒精
C . 分离碘和酒精 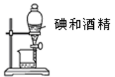 D . 收集少量二氧化氮气体
D . 收集少量二氧化氮气体 

-
(1) NaHCO3能用于治疗胃酸过多,反应的离子方程式为。
-
(2) 铁和水蒸气反应的化学方程式为3Fe+4H2O(g)
 Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
-
(3) 制备Fe(OH)3的实验操作:向煮沸的蒸馏水中加入几滴FeCl3溶液,。
-
(4) 密度为1.84g/cm3 , 质量分数为98%的浓硫酸的物质的量浓度为。

-
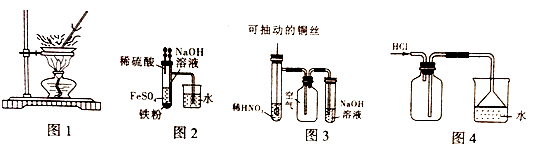
(1) B中盛一定量的NaOH溶液,A中应预先加入的试剂是,A中反应的离子方程式是:。
-
(2) 实验开始时就先将活塞E(填“打开”或“关闭”),C中收集到气体的主要成分是。
-
(3) 简述生成Fe(OH)2的操作过程。
-
(4) 拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:。
| A | B | C | D |
| | | | |
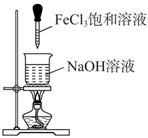
| 验证C的非金属性强于Si | 比较Fe2+和Cr3+还原性强弱 | 比较碳酸钠与碳酸氢钠的热稳定性 | 制备氢氧化铁胶体 |
 证明醋酸酸性比硼酸强
B .
证明醋酸酸性比硼酸强
B .  实验室制氢氧化亚铁
C .
实验室制氢氧化亚铁
C .  实验室制氨气
D .
实验室制氨气
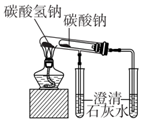
D .  证明碳酸氢钠热稳定性比碳酸钠弱
证明碳酸氢钠热稳定性比碳酸钠弱
 、
、  、
、 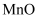 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: 
已知:pH较大时,二价锰[  ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
-
(1) Cr元素位于元素周期表第周期族。
-
(2) 用
 溶液制备
溶液制备 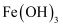 胶体的化学方程式为。
胶体的化学方程式为。
-
(3) 常温下,各种形态五价钒粒子总浓度的对数[
 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中  ,“沉钒”过程控制
,“沉钒”过程控制  ,则与胶体共沉降的五价钒粒子的存在形态为(填化学式)。
,则与胶体共沉降的五价钒粒子的存在形态为(填化学式)。 
-
(4) 某温度下,
 、
、  的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 
 (
(  近似为
近似为  ,
,  的
的  近似为
近似为  )。
)。
-
(5) “转化”过程中生成
 的离子方程式为。
的离子方程式为。
-
(6) “提纯”过程中
 的作用为。
的作用为。
 B . 证明过氧化钠与水反应放热
B . 证明过氧化钠与水反应放热 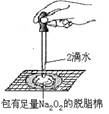 C . 制备并收集少量NO2气体
C . 制备并收集少量NO2气体  D . 实验室制备少量氨气
D . 实验室制备少量氨气 
| | | | |
| A.“随开随用、随关随停”制CO2 | B.收集氨气的试管口处放置湿棉花,防止氨气与空气形成对流 | C.用浓H2SO4干燥HCl气体 | D.观察Fe(OH)2的生成 |

 验证木炭和浓硫酸反应生成
验证木炭和浓硫酸反应生成 B .
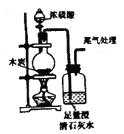
B . 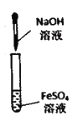 实验室制备
实验室制备 并能较长时间观察到白色固体
C .
并能较长时间观察到白色固体
C .  实验室制备和收集氨气并验满
D .
实验室制备和收集氨气并验满
D . 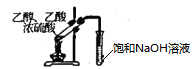 制备乙酸乙酯
制备乙酸乙酯