探究铁离子和亚铁离子的转化 知识点题库
①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中
-
(1) I.回答下列有关问题:
①向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒大小范围是nm。
②电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,生成FeCl2和CuCl2 , 制造印刷电路板。写出FeCl3溶液腐蚀铜的化学反应方程式:。检验反应后溶液中还存在Fe3+的试剂是。
③在下列化学方程式中:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O还原剂是.
-
(2) II.现有五种溶液,分别含下列离子:①Ag+ , ②Mg2+ , ③Fe2+ , ④Al3+ , ⑤Fe3+。
①写出符合下列条件的离子符号:既能被氧化又能被还原的离子是,加铁粉后溶液增重的是(填写离子符号)
②向Fe2+的溶液中滴加NaOH溶液,现象是 。
③欲除去FeCl2中FeCl3选用的试剂是 , 并写出相应离子方程式:。
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Na+、Fe3+、Cl-、I- | NaOH溶液 | Fe3++3OH-=Fe(OH)3↓ |
B | K+、NH3·H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
C | H+、Fe2+、SO42-、Cl- | Ba(NO3)2溶液 | SO42-+Ba2+=BaSO4↓ |
D | Na+、Al3+、Cl-、NO3- | 少量澄清石灰水 | Al3++3OH-=Al(OH)3↓ |
 溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()
溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()
-
(1) 写出FeCl3溶液与金属铜发生反应的离子方程式:。
-
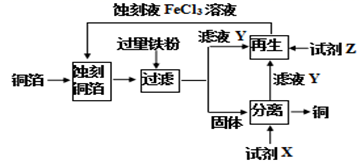
(2) 某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备用如图所示步骤:

A.写出上述实验中加入或生成的有关物质的化学式:
①;②;③;④;⑤;⑥。
B.写出下列过程中的离子方程式:
①→②;
⑤+⑥。
-
(1) 甲组同学拟用下列装置制取纯净干燥的氯气。
①装置B的作用是
②装置A中发生反应时消耗的氧化剂和还原剂的物质的量之比为
-
(2) 乙组同学选用甲组实验中的装置ABC和下列装置制取FeCl3
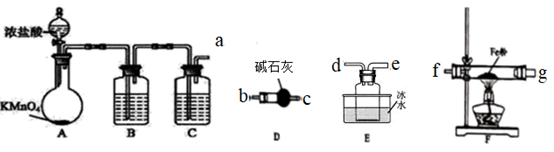
①乙组同学的实验装置中,依次连接的合理顺序为:a→→→→→→
②连好装置,检查装置的气密性,先打开装置A中(填仪器的名称)的活塞,直到再点燃装置F处的酒精灯,目的是
③装置D的作用有
-
(3) 实验结束后,取少量F中的固体加水溶解,欲对所得产物FeCl3中是否含有FeCl2进行检测,所需试剂是
a.KSCN b.H2O2 c.K3[Fe(CN)6] d. .K4[Fe(CN)6]
经检测发现溶液中含有Fe2+ , 丙同学认为所得产物FeCl3中一定含有FeCl2 , 丁同学认为不一定,理由是
| 选项 | 实验目的 | 实验操作 |
| A | 清洗内壁镀银的试管 | 先用稀盐酸洗,再用水清洗 |
| B | 除去FeCl2溶液中少量FeCl3 | 加入过量Cu粉,充分反应后过滤 |
| C | 制取并纯化SO2 | 向Na2SO3固体中加入70%H2SO4溶液,将产生的气体通98%浓硫酸 |
| D | 检验试样中含有Na+ | 用玻璃棒蘸取待测液,在酒精灯火焰上灼烧,火焰呈黄色 |
 B .
B . 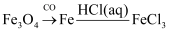 C .
C .  D .
D . 
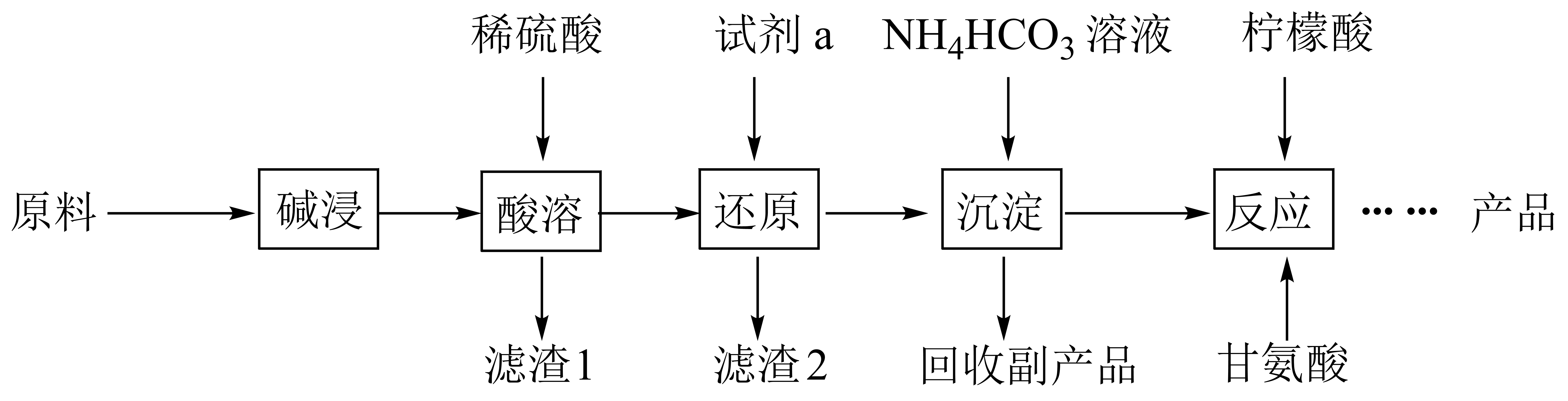
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
-
(1) “碱浸”去除的元素是,“滤渣1”是(填化学式)。
-
(2) “还原”时的还原产物是
-
(3) “沉淀”的离子方程式,“副产品”是(写名称)。
-
(4) 柠檬酸的作用防止Fe2+氧化,“反应”的化学方程式为
-
(5) FeSO4·7H2O也是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是,某同学通过如下实验测定该补血剂中Fe2+的含量:
①配制:用分析天平称取1.400gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水配制100mL溶液。配制时还需要的定量仪器是
②滴定:用酸化的KMnO4溶液滴定:用移液管移取25.00mLFeSO4溶液于锥形瓶中,用0.0100mol·L-1的KMnO4溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24.00mL,则样品Fe2+的含量为%(保留2位小数)。
 溶液中混有
溶液中混有 :加入过量铁粉充分反应后过滤
C .
:加入过量铁粉充分反应后过滤
C .  固体中混有少量
固体中混有少量 :加入适量稀盐酸
D .
:加入适量稀盐酸
D .  中混有
中混有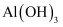 :加入足量NaOH溶液后过滤
:加入足量NaOH溶液后过滤



