探究铁离子和亚铁离子的转化 知识点题库
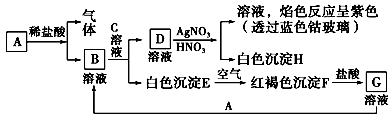
试回答:
-
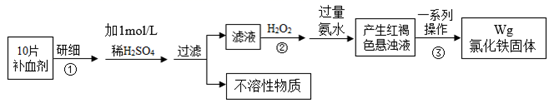
(1) 写出B的化学式,D的化学式。
-
(2) 写出由E转变成F的化学方程式。
-
(3) 写出向G溶液中加入A的离子方程式:;
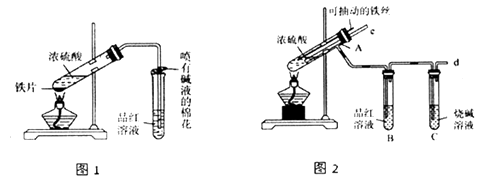
-
(1) 比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2 , 防止其污染环境;②。
-
(2) 导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻值SO2 气体逸出而防止污染环境;二是。
-
(3) 能说明有SO2气体产生的实验现象是。
-
(4) 反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有 以下三种可能:
I:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A 稀HCl溶液 B 稀硫酸 C KSCN溶液 D KMnO4溶液
E NaOH溶液 F 淀粉KI溶液 G H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号,溶液的颜色变色,则试样中含有Fe3+ , 发生反应的离子方程式为;
步骤2.再取适量的试样,滴加少量的(填试剂序号),溶液颜色的变化为,则试样中含有Fe2+。
实验Ⅰ:将Fe3+转化为Fe2+
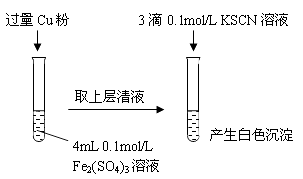
-
(1) Fe3+与Cu粉发生反应的离子方程式为。
-
(2) 探究白色沉淀产生的原因,请填写实验方案:
实验方案
现象
结论
步骤1:取4mLmol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液
产生白色沉淀
CuSO4与KSCN反应产生了白色沉淀
步骤2:取
无明显现象
查阅资料:ⅰ. SCN-的化学性质与I-相似 ⅱ. 2Cu2+ + 4 I-= 2CuI↓+ I2
Cu2+与SCN-反应的离子方程式为。
-
(3) 实验Ⅱ:将Fe2+转化为Fe3+
实验方案
现象
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸
溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色
探究上述现象出现的原因:
查阅资料:Fe2+ + NO
 Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2¯(蓝色)
Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2¯(蓝色)用离子方程式解释NO 产生的原因。
-
(4) 从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测符合题意,乙设计的实验方案是。
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因。
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-被还原为NH3 |
B | 將Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2样品中一定含有Fe3+ |
C | 向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S) > Ksp(Ag2CO3) |
D | 向KI溶液中加入少量苯,然后加入FeCl3溶液 | 有机层呈橙红色 | 还原性Fe2+>I- |
![]()
试回答下列问题:
-
(1) 试剂1是,试剂2是。
-
(2) 该同学预测加入试剂2后,溶液应依然为浅绿色,但这与实际现象不符,请用离子方程式解释实际现象的合理性:,。
-
(3) 用离子反应方程式解释加入新制氯水后溶液变血红色的原因:。
-
(4) 补铁药物的说明书中通常会有“与VC同服可增加本品吸收”的内容,向淡红色溶液中加入VC , 片刻后溶液红色褪去,试从氧化还原角度解释补铁药物与VC同服的优点:。
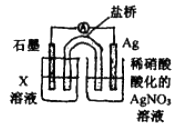
他们先向硝酸酸化的0.05mol/L AgNO3溶液(pH≈2) 中加入稍过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色; 经检验未生成其他含氮物质.
-
(1) 由“黑色固体”,甲猜测固体中含有Ag; 他取出少量黑色固体,洗涤后放入试管中,后续操作是,发现有白色沉淀产生。
-
(2) 乙取上层清液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。由此得出Fe与Ag+间发生的离子反应之一为。
-
(3) 由“溶液呈黄色”,丙猜测溶液中有Fe3+; 而丁认为在铁粉稍过量充分反应后的溶液中不可能合有Fe3+ , 其理由是(用离子方程式表示):。
丙为证实自己的猜测,取上层清液,滴加,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
ⅰ
3
产生大量白色沉淀;溶液呈红色
ⅱ
30
产生白色沉淀;较3 min时量少;溶液红色较3 min时加深
ⅲ
120
产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅
①“白色沉淀”是。
②丙对Fe3+产生的原因分析:
因“未生成其他含氮物质”,故认为Fe2+不是被氧化的。随后又提出了如下假设:
假设a:可能是铁粉表面有氧化层,与H+反应生成Fe3+;
假设b:Fe2+被O2氧化,而产生Fe3+;其对应的高子反应方程式为
假设c:氧化了Fe2+ , 而产生Fe3+
③丙为证实假设a、b不是主要原因,又补充了对比实验: 向硝酸酸化的(pH=2)中加入过量铁粉,搅拌后静置,不同时间取上层清液清加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
④戊为证实上述假设c成立,设计了如右图所示装置:分别取此电池工作前与工作-段时间电源计指针回至“0”时左池中的溶液,同时分别滴加K3[FeCN)6]溶液,后者蓝色沉淀较少;左池再滴加X的浓溶液,指针又有偏转。则X为溶液;该电池总反应的离子方程式为:。
-
(1) 用所给试剂写出体现Fe2+具有还原性的反.应的化学方程式:
。
-
(2) 设计实验方案,完成下列表格。
探究内容
实验方案
实验现象
探究Fe3+
取少量0.1 mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液
加入铁粉后,溶液颜色变为。加入KSCN溶液后,溶液
-
(3) 该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为。
-
(4) 某反应中反应物与生成物有Fe3+、Mn2+、H+、
 、H2O和一种未知离子X。
、H2O和一种未知离子X。 ①已知MnO在反应中得到电子,则X是。
②该反应的离子方程式是。
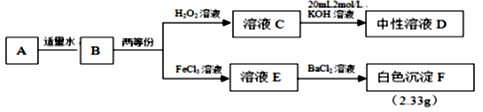
请回答:
-
(1) D中溶质的化学式,H2O2的电子式。
-
(2) A和水反应的化学方程式。
-
(3) B→E的离子方程式。
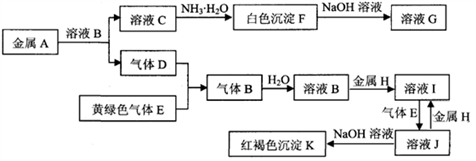
D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
-
(1) 写出下列物质中溶质的名称:B是 ,G是
-
(2) 反应“F→G”的化学方程式是
-
(3) 反应“J→I”的离子方程式是
-
(4) 溶液I中混有溶液J,除去J的方法是:
-
(5) 检验溶液I中阳离子的方法是:
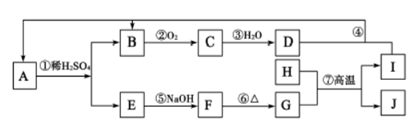
请填写下列空白:
-
(1) H元素在周期表中的位置是;写出①的离子反应方程式:;检验E溶液中阳离子的最佳试剂为。
-
(2) 这类反应常用于冶炼高熔点的金属。用MnO2冶炼金属锰的反应中氧化剂与还原剂的物质的量之比为。
-
(3) SCR技术处理机动车尾气时,在催化条件下利用氨气与C反应,生成无污染的物质。发生反应的化学方程式为。
-
(4) F与NaClO、NaOH溶液反应,可制得一种“绿色”高效净水剂K2FeO4。每生成1molFeO42-时转移mol电子。
-
(5) B为大气污染物,利用炭粉可以将其还原为无污染的物质X2。
已知:X2(g)+O2(g)=2XO(g) △H=+180.6kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出用碳粉还原B的热化学方程式。
| 选项 | a | b | c |
| A | Fe | FeCl2 | FeCl3 |
| B | Si | SiO2 | SiF4 |
| C | HNO3 | NO | NO2 |
| D | Al | Al2O3 | Al(OH)3 |
下列说法错误的是( )
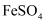 固体变质的情况。将0.3 g
固体变质的情况。将0.3 g  固体用10mL蒸馏水溶解,配成待测液,进行实验。
固体用10mL蒸馏水溶解,配成待测液,进行实验。
-
(1) (初步实验)
用KSCN检验
 的原理是(用离子方程式表示)。
的原理是(用离子方程式表示)。 -
(2) 甲同学认为
 固体几乎未变质,ⅱ中变血红色是由于
固体几乎未变质,ⅱ中变血红色是由于  被氧化,反应的离子方程式为;ⅱ中血红色褪去的可能原因是。
被氧化,反应的离子方程式为;ⅱ中血红色褪去的可能原因是。
-
(3) 乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是。
-
(4) (继续探究)
步骤
操作
现象
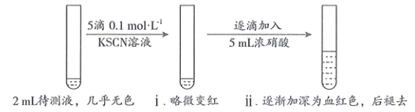
Ⅰ
取2mL待测液,加入5滴0.1
 KSCN溶液,再加入5mL浓
KSCN溶液,再加入5mL浓  溶液
溶液溶液颜色无明显变化
Ⅱ
取2mL待测液,
溶液变为红色
Ⅲ
向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡
溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显
-
(5) 请补全步骤Ⅱ中的操作:。
-
(6) 由Ⅰ~Ⅲ推测
 固体变质的情况是(填字母序号),理由是。
固体变质的情况是(填字母序号),理由是。 a.几乎未变质 b.部分变质 c.完全变质
-
(7) (反思与迁移)
从上述探究中获得启发,在用KSCN检验
 及进行
及进行  还原性验证实验时,需要注意的事项有(至少2条)。
还原性验证实验时,需要注意的事项有(至少2条)。
 B . 氢氧化亚铁为灰绿色絮状沉淀
C . 氢氧化亚铁易被空气氧化
D . 实验制备中,氢氧化钠溶液应预先煮沸
B . 氢氧化亚铁为灰绿色絮状沉淀
C . 氢氧化亚铁易被空气氧化
D . 实验制备中,氢氧化钠溶液应预先煮沸
| 选项 | 实验方案 | 现象 | 实验结论 |
| A | 向FeCl2溶液中滴加氯水 | 溶液由浅绿色变成棕黄色 | FeCl2被氯水氧化 |
| B | 将未打磨的铝片置于酒精灯上灼烧 | 铝片熔化但不滴落 | 铝表面附着一层致密的氧化膜 |
| C | 将某溶液滴到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 | 该溶液中可能含有Fe3+ |
| D | 将干燥的氯气通入装有鲜花的试剂瓶中 | 鲜花褪色 | 氯气具有漂白性 |
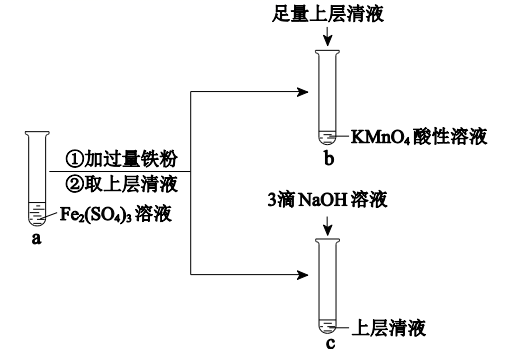
-
(1) 检验试管 a 的溶液中含有 Fe3+的实验方案为:在试管中加入少量 a 中溶液,(填操作和现象),说明其中含有 Fe3+。
-
(2) 向试管 a 中加入过量铁粉的离子方程式是。
-
(3) 试管 b 中的实验现象是。
-
(4) 试管 c 中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式。
-
(5) 实验小组为探究反应物浓度对 Fe(OH)2制备效果的影响,以 Fe(OH)2 沉淀白色持续时间(t)为指标,t 越大,实验效果越好。部分实验数据如下:
实验
序号
w(FeSO4)/%
w(NaOH)/%
t/s
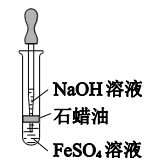
i
2.5
15
149
ii
5
15
138
iii
10
15
93
iv
5
25
142
v
5
35
180
①实验 i、ii、iii 的目的是。
②小组同学通过实验推断:其他条件不变时,所用 NaOH 溶液的浓度越大,实验效果越好。推断的证据是。

下列叙述不正确的是( )
 FeCl2
FeCl2  Fe(OH)2
B . S
Fe(OH)2
B . S  SO3
SO3 H2SO4
C . NH4Cl (s)
H2SO4
C . NH4Cl (s) NH3
NH3 Mg(OH)2
D . Al2O3
Mg(OH)2
D . Al2O3 Al(OH)3
Al(OH)3 NaAlO2
NaAlO2



