氯离子的检验 知识点题库
①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2 , 反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
-
(1) 第①步反应的化学方程式为 。第②步反应的化学方程式为 。
-
(2) 可循环使用的物质是 。工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
-
(3) 检验CaO2·8H2O是否洗净的方法是 。
-
(4) CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。
-
(5)
已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。

查阅资料可知:
①常温下:Ksp(BaSO4)=1.0×10-10 , Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O
请回答下列问题:
-
(1) 工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3 , 该过程用离子方程式可表示为,此反应的平衡常数K=(填写计算结果)。若不考虑CO32-的水解,则至少需要使用mol/L的Na2CO3溶液浸泡重晶石才能实现该转化过程。
-
(2) 配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是。
-
(3) 可循环使用的物质X是(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:。
-
(4) 写出煅烧草酸氧钛钡晶体的化学方程式:。
 和
和  的混合物经溶解、过滤,洗涤、干燥,可分离出
的混合物经溶解、过滤,洗涤、干燥,可分离出  C . 用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D . 火柴头的浸泡液中滴加
C . 用容量瓶配制溶液,定容时若加水超过刻度线,立即用滴管吸出多余液体
D . 火柴头的浸泡液中滴加  溶液,稀
溶液,稀 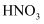 和
和  溶液,可检验火柴头是否含有氯元素
溶液,可检验火柴头是否含有氯元素
| 选项 | 目的 | 方案设计 | 现象和结论 |
| A | 探究Cu(OH)2和Mg(OH)2溶解度大小 | 向氢氧化钠溶液中先加入少量MgCl2溶液,充分反应后再加入少量CuSO4溶液 | 先产生白色沉淀,后产生蓝色沉淀,则证明Cu(OH)2比Mg(OH)2难溶 |
| B | 检验铁与水蒸气反应中有三价铁 | 取少量铁与水蒸气反应后的固体,先加入稀盐酸再加KSCN溶液 | 若溶液变血红色,则有三价铁,若不变血红色则无三价铁 |
| C | 检验牙膏中是否有甘油 | 取少量该牙膏于试管中,加入适量蒸馏水,搅拌静置后,取上层清液,加入适量新制Cu(OH)2 , 观察现象 | 若产生绛蓝色沉淀,则该牙膏中含有甘油 |
| D | 检验火柴头中的氯元素 | 摘下几根火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加硝酸酸化的AgNO3和NaNO2 | 若观察到白色沉淀,则含氯元素 |
| 选项 | 实验 | 现象 | 结论 |
| A | 将铝丝和铜丝接触,并放入冷的浓硝酸中浸泡一段时间 | 铝丝上有红棕色气体产生 | 形成了原电池,且负极反应为Cu﹣2e﹣═Cu2+ |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 向某溶液中加入稀硝酸酸化的Ba(NO3)2溶液,再加入AgNO3溶液 | 开始无现象,后有沉淀生成 | 原溶液中一定含有Cl﹣ |
| D | 将盐酸和大理石反应生成的CO2气体直接通入Na2SiO3溶液中 | 产生白色沉淀 | 证明酸性:碳酸>硅酸 |
| 实验操作 | 现象 | 结论 | |
| A | 某溶液用足量硝酸酸化后无明显现象,再滴加AgNO3 | 有白色沉淀生成 | 该溶液中一定含有Cl- |
| B | 取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧 | 火焰呈黄色 | 该试液一定含有Na+ , 不能确定是否含有K+ |
| C | 取少量NaHCO3固体物质,加入几滴水,插入温度计 | 温度下降 | 碳酸氢钠溶解过程吸热 |
| D | 某溶液中加入盐酸 | 产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定存在 |
 B . 某溶液加入NaOH溶液,将湿润红色石蕊试纸靠近试管口无颜色变化,则溶液中一定不含
B . 某溶液加入NaOH溶液,将湿润红色石蕊试纸靠近试管口无颜色变化,则溶液中一定不含  C . 某溶液中加入AgNO3溶液,再加足量的稀HNO3仍有白色沉淀,说明溶液中一定有Cl-
D . 某无色溶液通过焰色反应并透过蓝色钴玻璃看到火焰呈紫色,则该溶液中一定含钾盐
C . 某溶液中加入AgNO3溶液,再加足量的稀HNO3仍有白色沉淀,说明溶液中一定有Cl-
D . 某无色溶液通过焰色反应并透过蓝色钴玻璃看到火焰呈紫色,则该溶液中一定含钾盐
 氧化性强,稳定性好,常用于杀菌消毒
C . 氯水呈酸性,可用
氧化性强,稳定性好,常用于杀菌消毒
C . 氯水呈酸性,可用  试纸准确测得其
试纸准确测得其  D . 溶液中加入
D . 溶液中加入  溶液有白色沉淀生成,则原溶液中一定有
溶液有白色沉淀生成,则原溶液中一定有 
 比硫酸亚铁中
比硫酸亚铁中  要稳定,不易被氧化
D . 探究
要稳定,不易被氧化
D . 探究  与稀硫酸反应速率的影响因素时,可以通过观察产生浑浊的速率来判断反应的快慢
与稀硫酸反应速率的影响因素时,可以通过观察产生浑浊的速率来判断反应的快慢
 C . 滴加KSCN溶液变血红色,一定含有Fe3+
D . 滴加硝酸酸化的AgNO3溶液有白色沉淀生成,一定含有Cl-
C . 滴加KSCN溶液变血红色,一定含有Fe3+
D . 滴加硝酸酸化的AgNO3溶液有白色沉淀生成,一定含有Cl-
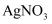 溶液产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中一定含有
溶液产生白色沉淀,再加入稀盐酸,沉淀不消失,则该无色溶液中一定含有
-
(1) 海水淡化主要用蒸馏法。实验室蒸馏操作用到的主要仪器有(选填必要序号)。

-
(2) 海水中主要含有Mg2+、SO
 、K+、Cl-等离子,简述实验检验其中SO
、K+、Cl-等离子,简述实验检验其中SO 的实验操作与现象;简述实验检验其中Cl-的实验操作与现象。
的实验操作与现象;简述实验检验其中Cl-的实验操作与现象。
-
(3) 海藻中富含碘元素,实验室模拟海藻提取KI的流程如图:

在灼烧、溶解、过滤、蒸发四个步骤中,均要使用到的一种实验仪器为。小铭想要配制100mL0.2mol/L的KI溶液,需称量KI的质量为g,实验操作示意图如图,请你将其正确排序(填数字序号)。

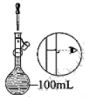




①
②
③
④
⑤
⑥
-
(4) 海水中含有大量矿物质,你认为海水中会富含石油吗?(填“会”或“不会”)。




