氮的氧化物的性质及其对环境的影响 知识点题库
(1)某溶液中可能含有HCO3﹣、Cl﹣、SO42﹣、NO3﹣、CO32﹣等阴离子.
当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是 .
当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是 .
(2)硅是现代信息材料重要的物质,写出工业上制取粗硅的方程式 .
(3)在铝制易拉罐中收集一满罐CO2 , 加入过量浓NaOH溶液,立即把口封闭,可以发现易拉罐变瘪了;过了一会儿易拉罐又鼓起来了.请用离子方程式描述变化过程
(4)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与水反应的化学方程式: .
(5)比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题,Na2O2可能与所有的常量气态非金属氧化物反应.如2Na2O2+2CO2═2Na2CO3+O2 , Na2O2+CO═Na2CO3 .
通过比较可知,当非金属元素处于高价时,其氧化物与Na2O2反应有O2生成;
试分别写出Na2O2与SO2、SO3反应的化学方程式:
(6)室温时,将盛有20mLNO2和O2混合气体的量筒倒立在盛有水的水槽中,充分反应后,量筒内残留气体3mL,则原混合气体中NO2的体积可能是 .
-
(1) 配平: Zn+HNO3(很稀)═ Zn(NO3)2+NH4NO3+H2O
-
(2) 写出实验室制取NH3的化学方程式:
-
(3) 除去一氧化氮中的少量二氧化氮的最好方法(用方程式表示);
-
(4) 在含Cu+的酶(催化剂)的活化中心,亚硝酸根离子(NO
 )可转化为NO,写出Cu+在酸性水溶液中与NO
)可转化为NO,写出Cu+在酸性水溶液中与NO  反应的离子方程式:.
反应的离子方程式:.

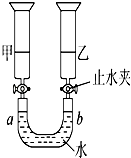

-
(1) 设计装置A的目的是,为达此目的应进行的操作;A中反应的化学方程式是。
-
(2) 在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是;B中反应的离子方程式是。
-
(3) 装置E和F的作用是,为实现此目的,操作方法是。
-
(4) D装置的作用是。
-
(1) 甲组同学直接用铜屑与稀硝酸反应制取Cu(NO3)2 , 反应的化学方程式是。
-
(2) 乙组同学查阅了硝酸铜晶体的溶解度曲线(下图),据此设计了以下实验方案,先将铜粉在空气中充分灼烧,再将灼烧后的物质与适量稀HNO3反应,欲从反应后的溶液中得到Cu(NO3)2晶体,依次进行的操作是:蒸发浓缩、、过滤、洗涤、干燥。乙组同学认为此方案优于甲组的方案,理由之一是。
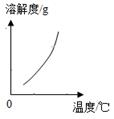
-
(3) 丙组同学用Cu(NO3)2晶体,探究其热稳定性,实验装置如下所示。(夹持装置和加热仪器未画出)
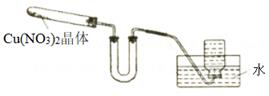
①充分加热Cu(NO3)2晶体一段时间后,观察到U形管中气体变为红棕色,红棕色气体是。
②集气瓶中最终收集到的气体颜色是,U形管中进入集气瓶后颜色发生变化的原因是。
③欲证明试管中残留的黑色粉末是CuO[假设Cu(NO3)2晶体已全部分解],实验方案是。
④由该实验可得出的结论是。
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将氯化铁溶液加热灼烧 | 有固体析出 | 该固体是氯化铁 |
| B | 氯化铜溶液中有氯化铁杂质,加入氧化铜除杂 | 有红褐色物质析出 | 调节pH使铁离子水解平衡右移 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
| D | 向1 mL 0.1 mol/L的AgNO3溶液中加入4滴0.1 mol/L的NaCl溶液,再加10滴0.1 mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |

 性质的叙述不正确的是( )
性质的叙述不正确的是( )
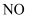 易溶于水,不能用排水法收集
C . 可以在放电条件下由氮气和氧气反应得到
D . 在空气中能自动与氧气反应生成
易溶于水,不能用排水法收集
C . 可以在放电条件下由氮气和氧气反应得到
D . 在空气中能自动与氧气反应生成 
-
(1) 氮在元素周期表的位置为,其非金属性比磷(填“强”或“弱”)。氮气的化学性质很稳定,原因是。
-
(2) 1909年,德国科学家哈伯利用氮气和氢气在500~600℃、18.5~20.0
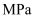 和锇为催化剂的条件下合成氨气。下列关于工业上合成氨的说法合理的是____。
A . 合成氨属于人工固氮 B . 合成原料氢气主要通过电解水获得 C . 将生成的氨气分离,可加快反应速率 D . 通过改良催化剂,可使反应更易发生
和锇为催化剂的条件下合成氨气。下列关于工业上合成氨的说法合理的是____。
A . 合成氨属于人工固氮 B . 合成原料氢气主要通过电解水获得 C . 将生成的氨气分离,可加快反应速率 D . 通过改良催化剂,可使反应更易发生 -
(3) 某兴趣小组在实验室中探究氮的氧化物的性质。
①利用铜和稀硝酸制取NO,化学方程式为,该反应中还原剂与氧化剂物质的量之比为。
②探究氮的氧化物性质的实验步骤及预期现象如下表:

步骤
预期现象
i.在一支注射器中吸入22.4mLNO(标准状况下),然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器
无明显现象
ii.打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,固定住注射署活塞
iii.松开注射器活塞,再振荡注射器
重复操作ii和iii,充分反应后,注射器中的溶液浓度为mol/L(假设反应前后液的体积几乎不变)。
-
(4) 利用
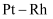 合金催化氧化
合金催化氧化 制取
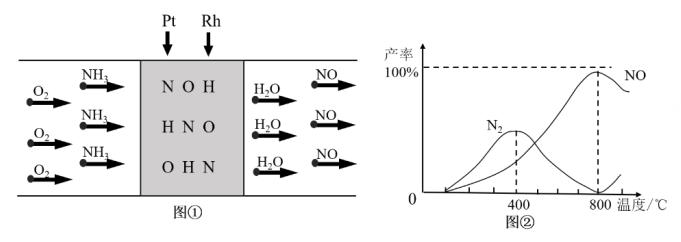
制取 , 图①是反应的微观模型,含氮生成物产率反应温度的变化曲线如图②所示。下列说法正确的是____。
, 图①是反应的微观模型,含氮生成物产率反应温度的变化曲线如图②所示。下列说法正确的是____。
 A . 可用湿润的蓝色石蕊试纸检验
A . 可用湿润的蓝色石蕊试纸检验 是否反应完全
B . 400℃时,生成的产物只有
是否反应完全
B . 400℃时,生成的产物只有 、
、 C . 800℃以上,可能发生反应:
C . 800℃以上,可能发生反应: D .
D .  合金催化氧化
合金催化氧化 制取
制取 , 适宜的温度为800℃
, 适宜的温度为800℃
 、
、 是形成酸雨的主要物质。研究
是形成酸雨的主要物质。研究 、
、 等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
-
(1) 酸雨是指
 小于的雨水。
小于的雨水。
-
(2) 你认为减少酸雨的产生可采取的措施有(填序号)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰
-
(3) 开发新能源可有效减少酸雨。下列能源不属于新能源的有(填序号)。
①太阳能 ②风能 ③地热能 ④海洋能 ⑤氢能 ⑥石油 ⑦无烟煤
-
(4)
 主要来源于汽车尾气。通过
主要来源于汽车尾气。通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 含量,其工作原理如下图。据此回答:
含量,其工作原理如下图。据此回答: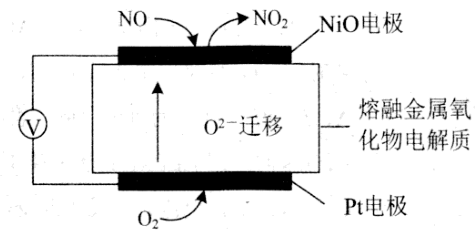
 电极为(填“正极”或“负极”);其电极反应式为。
电极为(填“正极”或“负极”);其电极反应式为。 -
(5) 可用氨水将
 转化为
转化为 , 再用
, 再用 氧化成
氧化成 来脱除烟气中的
来脱除烟气中的 , 原理是、(用离子方程式表示)。
, 原理是、(用离子方程式表示)。
 N2O4的△H>0
N2O4的△H>0


