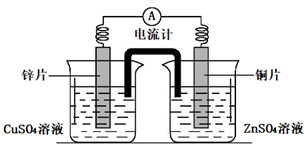
氮的氧化物的性质及其对环境的影响 知识点题库
-
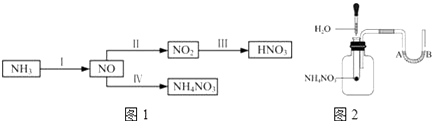
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
-
(2) 在汽车尾气系统中安装催化转化器,可将NOX还原成无害物质排出.
写出NO被CO还原的化学方程式:
-
(3) 工业上通常用NOx+NH3→N2+H2O来消除NOx的污染.现有NO2和NO的混合气体3L,用3.5LNH3恰好使其完全转化为N2 , 则混合气体中NO2和NO的体积之比为 (气体体积在同条件下测定);
-
(4) 实验室中NOx的尾气常采用碱溶液来吸收,主要反应为:2NO2+2NaOH═NaNO2+NaNO3+H2O,
NO2+NO+2NaOH═2NaNO2+H2O.现有标准状况下aL NO2和bL NO,若用500mLNaOH溶液能恰好吸收完全,则NaOH溶液物质的量浓度是 mol•L﹣1(用含有a、b的代数式表示);
-
(5) 将9mLNO2依次通过足量的饱和NaHCO3溶液、浓硫酸、Na2O2之后,用排水法将残留气体收集到集气瓶中,充分吸收后,保持温度和压强与初状态相同,此时集气瓶中的气体体积为 (不考虑水蒸气).
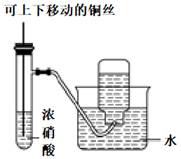
【资料卡片】
i.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
ii.在230℃以上时,同时有弱光:2NH4NO3═2N2↑+O2↑+4H2O
iii.在400℃以上时,剧烈分解发生爆炸:4NH4NO3═3N2↑+2NO2+8↑H2O
-
(1) 如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因.一段时间后还能观察到的现象是.
-
(2) 实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是,能否用硝酸铵代替氯化铵,(填“能”或“不能”),理由是.
-
(3) 从反应类型角度分析在I~IV的转化过程中的共同点是。
-
(1) 火箭用N2H4和NO2作燃料,产物绿色无污染,该反应的化学方程式为。
-
(2) 为探究NO2和铁粉反应的产物,某小组按下图所示装置进行实验。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21 ℃),NO(-152 ℃)
③酸性KMnO4溶液能氧化NO生成NO3-
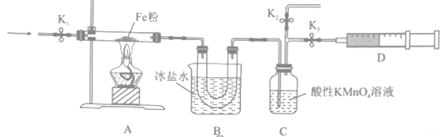
①按上图所示组装完实验仪器后,下一步操作为。
②实验前需利用气体X将装置的空气排净,气体X可以为(填标号)。
A.Ar
B.H2
C.CO
D.NO2
③排净空气后,后续实验的最佳操作顺序是(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2 , 关闭K3 , 缓缓通入气体X d.打开K1和K3 , 关闭K2 , 缓缓通入NO2 e.关闭K1 , 停止通入NO2
④装置B的作用是。
-
(3) 分析NO2和铁粉反应的产物
①实验过程中A 、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:。
③实验得到的相关数据如下表:
玻璃管质量/g
Fe 质量/g
反应后(玻璃管 +固体)/g
m
1.12
m+1.52
综合实验现象和计算可知,固体生成物一定有(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为

已知:在溶液中,FeSO4+NO ![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是()
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是()
资料:除浅黄色的AgNO2难溶于水外,其余亚硝酸盐均易溶于水。
-
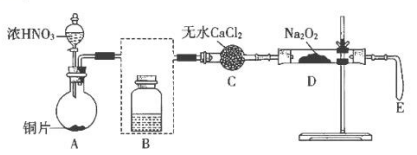
(1) 写出A中反应的化学方程式:。
-
(2) 将装置B补充完整,并标明试剂。
-
(3) 用无水CaCl2除去水蒸气的目的是。
-
(4) 反应一段时间后,D处有烫手的感觉,其中固体由淡黄色变为白色,直至颜色不再变化时,气囊E始终没有明显鼓起。
①学生依据反应现象和氧化还原反应规律推断固体产物为NaNO2。写出该反应的化学方程式:。
②设计实验证明的NaNO2生成,实验方案是。(写出操作、现象和结论)
已知:FeSO4+NO  [Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量2+时突显明显棕色。
[Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量2+时突显明显棕色。
-
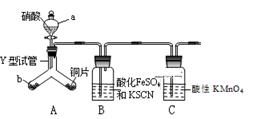
(1) 实验前需检验装置的气密性,简述操作。
-
(2) 仪器a的名称
-
(3) 实验开始时先将Y形试管向盛有块状固体b的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是;
-
(4) 证明有NO2的实验现象
-
(5) 装置C的作用,反应离子方程式。
-
(6) 测定化学试剂绿矾(FeSO4·7H2O)纯度的方法:称取绿矾3.000g置于锥形瓶中,加入100mL蒸馏水,加入10mLH2SO4和5mLH3PO4 , 用0.1000molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液20.00mL。KMnO4溶液盛放在棕色式(填“酸”或“碱”)滴定管中,列式计算绿矾的纯度。
-
(1) 汽车燃料中一般不含氮,尾气中所含的NO产生的原因是,化学方程式为。
-
(2) 治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装上一个催化转化装置,使NO和CO反应,生成CO2和N2。反应的化学方程式为。
-
(3) 下列措施中,能减少或控制汽车尾气污染有效且可行的是。
①制定严格的尾气排放标准,并严格执行。
②开发清洁能源,如氢能汽车、太阳能汽车等。
③市民出行戴防毒面具。
④市民大量移居城市郊区。
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 向某无色溶液中通入过量的CO2气体 | 有白色沉淀产生 | 该溶液中一定含SiO |
| B | 向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加入NaOH溶液至碱性,加入少量碘水 | 溶液未变蓝 | 淀粉已完全水解 |
| C | 将带火星的木条和加热至液态的钠分别伸入盛有NO2的集气瓶中 | 木条不复燃,钠燃烧 | NO2的助燃性具有选择性 |
| D | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无NH |
| | | | |
| 图1 | 图2 | 图3 | 图4 |
| 实验操作和现象 | 结论 | |
| A | 将溴乙烷和过量NaOH溶液混合共热并充分振荡,冷却后加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有发生取代反应 |
| B | 向淀粉溶液中加入几滴稀硫酸,煮沸,冷却后加入少量银氨溶液,水浴加热,无银镜生成 | 淀粉水解的产物没有还原性 |
| C | 向1mL0.1mol·L-1FeCl3溶液中滴加2mL0.1mol·L-1KI溶液,充分反应后,滴加几滴KSCN溶液变为红色 | FeCl3与KI的反应是可逆反应 |
| D | 将湿润的淀粉—KI试纸置于集满红棕色气体的集气瓶口,试纸变蓝 | 证明该气体为Br2 |
 、
、  、
、 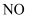 组成的混合气体,这些气体与
组成的混合气体,这些气体与  (标准状况)
(标准状况)  混合后通入水中,能完全被水吸收生成硝酸。则消耗铜的质量为( )
混合后通入水中,能完全被水吸收生成硝酸。则消耗铜的质量为( )
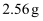 B .
B .  C .
C . 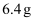 D .
D . 
-
(1) 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①

②
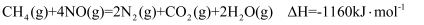
若用标准状况下4.48LCH4将NO2还原为N2 , 则放出的热量为kJ。
-
(2) 氮氧化物(NOx)是有毒的大气污染物,可以采用如图装置有效去除氮的氧化物,电解过程中,电极Pt(I)上发生反应:。

-
(3) 将一定比例混合均匀的O2、NH3和NOx气体,匀速通入装有催化剂M的反应器中反应,模拟NOx的去除。在不同温度下,相同时间内,测得NOx的去除率如图所示,低于50℃时,NOx去除率较低可能原因是,50~100℃时,NOx去除率迅速上升,可能原因是。
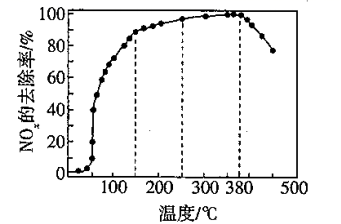
-
(4) 一定温度下,在容积恒为10L的密闭容器中,充入0.3molNO与过量的金属Al,发生的反应存在平衡:
 。已知NO、N2的消耗速率与各自的浓度存在关系(k1、k2为速率常数):
。已知NO、N2的消耗速率与各自的浓度存在关系(k1、k2为速率常数):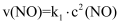 ,
,  。
。①在T1温度下,
 ,
,  , 该温度下反应的平衡常数的值为。
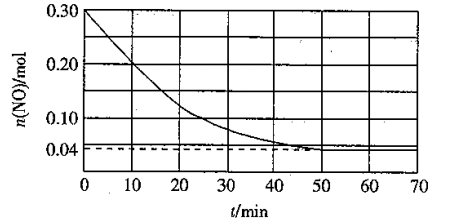
, 该温度下反应的平衡常数的值为。②T2温度下,NO的物质的量随时间的变化关系如图所示,其平衡常数为。

 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计如图流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计如图流程:
回答下列问题:
-
(1) 上述工业废气中可能造成环境污染的气体有(至少写两种),固体1含有的物质是、CaCO3、Ca(OH)2;气体2中捕获剂所捕获的气体主要是。
-
(2) 若X是空气,则上述反应中NO和O2的物质的量之比最好为,才能恰好转化为NaNO2溶液;若通入空气过量,导致的结果会是。
-
(3) 检验废水中含NH
 的方法是,流程中处理含NH
的方法是,流程中处理含NH 废水时反应的离子方程式为。
废水时反应的离子方程式为。
-
(4) 气体1中的有毒气体还可通过催化剂直接转化为无污染气体,反应的化学方程式为。