过氧化氢 知识点题库

-
(1) 请举出H2O2的一种用途.
-
(2) H2O2是一种二元弱酸,请写出它的第一步电离方程式.
-
(3) 将H2O2溶液加入盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式并标出电子转移情况.
-
(4) 向盛有少量过氧化钠固体的试管中滴加水,直到气体不再放出,再加水稀释所得溶液,将得到的溶液平均分成两份盛放在两只试管中,进行下列实验:①一只试管中滴加酚酞试液,溶液变红.半分钟红色褪去;②另一只试管中加入少量二氧化锰.又有气体放出,待气体不再放出,再滴加酚酞,溶液变红,持久不褪色.上述实验表明,过氧化钠和水反应可分两步,其化学方程式为:
第一步:;第二步.
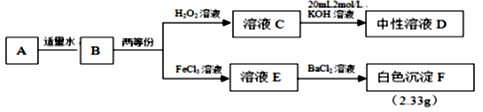
请回答:
-
(1) D中溶质的化学式,H2O2的电子式。
-
(2) A和水反应的化学方程式。
-
(3) B→E的离子方程式。
| 选项 | 操作 | 现象 | 结论 |
| A | 向某滴有酚酞的NaOH溶液中通入SO2 | 溶液红色褪去 | SO2具有漂白性 |
| B | 向H2O2溶液中滴加少量硫酸酸化的FeSO4溶液 | 溶液变为棕黄色后迅速出现大量气泡 | Fe2+催化H2O2发生分解反应生成O2 |
| C | 向相同浓度的Na2CO3、Na2SO4溶液中滴加酚酞 | Na2CO3溶液变红、Na2SO4溶液不变红 | S的非金属性大于C |
| D | 将相同体积、相同pH的盐酸和醋酸溶液稀释a倍、b倍 | 稀释后溶液pH值相等 | a>b |
| 实验操作 | 实验现象 | 结论 | |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
| B | 向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成 | Fe3+催化H2O2分解产生O2 |
| C | 铝片先用砂纸打磨,常温下再加入到浓硝酸中 | 无明显现象 | 常温下,铝不跟浓硝酸反应 |
| D | 向浓度均为0.01mol·L-1的KCl、KI的混合液中逐滴滴加稀AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
-
(1) 某工业废水中含有一定量的
 和
和  ,二者存在平衡:2
,二者存在平衡:2  (黄色)+2H+
(黄色)+2H+ 
 (橙色)+2H2O
(橙色)+2H2O ①若平衡体系滴加少量浓H2SO4(不考虑温度的影响),溶液显色。
②能说明该反应达平衡状态的是。
a.
 和
和  的浓度相同 b.2v(
的浓度相同 b.2v(  )=v(
)=v(  ) c.溶液的颜色不变
) c.溶液的颜色不变 -
(2) H2O2 稀溶液易被催化分解,可使用的催化剂为(填序号)。
a.MnO2 b.FeCl3 c.Na2S2O3 d.KMnO4
-
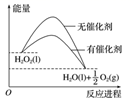
(3) 密闭容器中发生如下反应:A(g)+3B(g)
 2C(g) ΔH<0,根据下列速率—时间图象,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图象,回答下列问题。 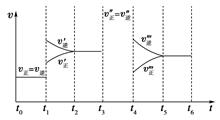
①下列时刻所改变的外界条件是:
t1;t3;t4;
②产物C的体积分数最大的时间段是;
③反应速率最大的时间段是。
 、
、  、
、  (超氧化氢)等都属氢氧化合物,其中
(超氧化氢)等都属氢氧化合物,其中  又叫超氧酸,与
又叫超氧酸,与  化学性质相似,又与
化学性质相似,又与 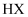 (
( 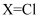 、
、 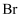 、I等)某些性质相似,下列说法错误的是( )
、I等)某些性质相似,下列说法错误的是( )
 溶液中滴入品红溶液,品红褪色,加热后红色不恢复
B .
溶液中滴入品红溶液,品红褪色,加热后红色不恢复
B .  在碱中能稳定存在
C .
在碱中能稳定存在
C .  不稳定,分解会生成氧气
D .
不稳定,分解会生成氧气
D .  可与
可与 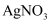 溶液反应:
溶液反应: 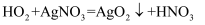
|
操作 |
现象 |
|
向盛有少量Na2O2的试管中加入蒸馏水,得到溶液a |
反应剧烈,产生能使带火星木条复燃的气体 |
|
然后向溶液a中滴入两滴酚酞 |
溶液先变红,再逐渐变浅,约10分钟溶液变为无色 |
为了探究溶液变为无色的原因,该同学按照科学的程序,进行了如下实验:
-
(1) (推理与假设)
Na2O2与H2O反应的化学方程式。向溶液a中滴加酚酞本应只会变红,而实验中发现酚酞变红后又褪色。由此提出如下的假设:
假设A:O2有漂白性 假设B:NaOH有漂白性 假设C:O2和NaOH共同作用有漂白性
-
(2) (实验与观察)
请完成下表:
实验编号
1
2
3
实验装置
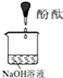
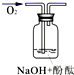
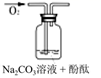
实验假设(填“A”、“B”或“C”)
假设
假设
假设
实验现象
溶液变红后10分钟均无变化
实验结论
-
(3) (查阅资料)
该同学查阅资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
(推理与假设)
该同学认为褪色的原因可能是溶液a中存在H2O2 , H2O2漂白了酚酞。
(实验与观察)
通过实验证实了H2O2的存在:取少量溶液a,加入黑色粉末(填化学式),快速产生了能使带火星木条复燃的气体。该同学进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案:取少量溶液a于试管中,。
-
(4) (解释与结论)
由以上实验结果可知,Na2O2与H2O反应的化学方程式如果分两步书写,应为;但课本上没有写出中间产物H2O2 , 可能的原因是。

-
(1) 由实验现象所得出的有关Na2O2和H2O反应的结论如下,请补充完整:
a.有生成; b.反应放热;Na2O2与水反应的化学方程式是。
-
(2) 某研究性学习小组拟用下图装置进行实验,以证明上述结论。
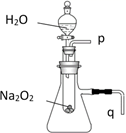
①用以验证结论a的实验方法:打开分液漏斗活塞,。
②用以验证结论b的实验方法:反应前将q导管口连接一橡胶管浸入盛有水的水槽中,滴入水后,观察到,证明反应是放热的。
-
(3) 实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞溶液,发现溶液变红,振荡后,红色褪去。针对褪色现象,查阅资料发现原因之一是反应后溶液中有H2O2 , 使酚酞氧化漂白。同学们向反应后溶液中加入,可观察到,说明有H2O2存在。
| 选项 | 实验操作 | 实验目的 |
| A | 向海带灰浸取液中滴加淀粉溶液 | 检验海带中的碘元素 |
| B | 向H2O2中加少量MnO2固体 | 加快H2O2的分解 |
| C | 将乙酸乙酯粗品加入氢氧化钠溶液中, 分液 | 提纯乙酸乙酯 |
| D | 分别将一小块钠投入水和乙醇中 | 比较水分子中氢原子与乙醇中羟基氢原子的活泼性 |
-
(1) 向100 mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
①在0~1、1~2、 2~3、3-4、4~-5min各时间段中:
反应速率最大的时间段是 min,主要的原因可能是。
反应速率最小的时间段是 min,主要的原因可能是。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入(填序号)。
a Na2CO3溶液 b NaOH溶液 c 稀HNO3 d 蒸馏水
-
(2) 进行以下对比实验,并记录实验现象。
实验I:
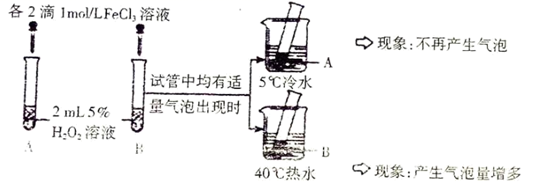
实验II:另取两支试管分别加入5 mL5%H2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡产生。
①双氧水分解的化学方程式是。
②实验I的目的是。
③实验II未观察到预期现象,为了达到该实验的目的,可采取的改进措施是。
 ,它具有氧化漂白作用。下列物质中漂白原理与过氧乙酸不同的是( )
,它具有氧化漂白作用。下列物质中漂白原理与过氧乙酸不同的是( )
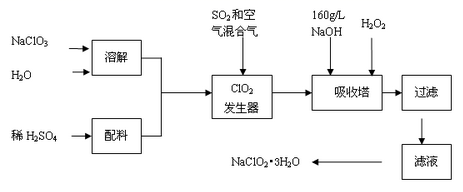
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸
则下列说法错误的是( )

-
(1) 实验一:取
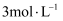 的
的  溶液各10mL分别进行下列实验,实验报告如下表所示。
溶液各10mL分别进行下列实验,实验报告如下表所示。
序号
V(过氧化氢溶液)/mL
V(氯化铁溶液)/mL
二氧化锰质量/g
反应温度/℃
V(水)/mL
结论
1
10
2
0
50
8
2
10
2
0
30
8
3
10
0
1
30
a
①实验1、2研究的是对
 分解速率的影响。
分解速率的影响。②表中数据a的值应该为;实验2、3研究的是对
 分解速率的影响。
分解速率的影响。③如果实验3中30s时共收集到气体的体积为11.2mL(已折算成标准状况下),则用过氧化氢表示的0~30s的平均反应速率为
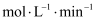 。
。 -
(2) 实验二:已知
 对
对  分解也具有催化作用,为比较
分解也具有催化作用,为比较  和
和  对
对  分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。
分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题。

①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是。
-
(3) 实验三:取等量的氯酸钾分别加入A、B两试管中,直接加热A试管中的氯酸钾,基本无气体产生;向B试管中再加入少量高锰酸钾,生成气体体积与时间的关系如图。不考虑温度的影响,分析:图中
 前,B试管中产生气体的速率较慢且量少的原因可能为,
前,B试管中产生气体的速率较慢且量少的原因可能为,  后,B试管中产生气体的速率较快且量多的原因可能为。
后,B试管中产生气体的速率较快且量多的原因可能为。




