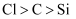过氧化氢 知识点题库
选项 | 陈述I | 陈述II |
A | H2O2有氧化性 | 双氧水能使酸性KMnO4溶液褪色 |
B | 盐的水解是吸热反应 | 加热可提高水解反应速率 |
C | KSCN可用来检验Fe3+ | 用KSCN溶液检验FeSO4是否变质 |
D | Al(OH)3是两性氢氧化物 | Al(OH)3可溶于过量的浓氨水中 |

-
(1) 过氧化氢属于(极性/非极性)分子.
-
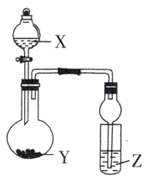
(2) Na2O2 , K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经操作即可制得,则上述最适合的过氧化物是.
-
(3) 几乎所有古代艺术家的油画都是以铅白2PbCO3•Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式:.
-
(4) 甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%﹣70%的过氧化氢溶液中,①则该反应的化学方程式为,②过氧化氢比理论用量稍多,其目的是. ③反应温度最好控制在30﹣70℃,温度不易过高,其主要原因是.
-
(5) 图2是硼氢化钠(NaBH4)一过氧化氢燃料电池示意图,该电池负极的电极反应方程式为.
-
(6) 过氧化氢与碳酸钠的加合物 Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100g Na2CO3•xH2O2晶体加热,实验结果如图1所示,则该晶体的组成为.
如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈血红色.判断下列说法中不正确的是( )

⑴活性炭⑵氯水⑶二氧化硫⑷臭氧 ⑸过氧化钠 ⑹双氧水.
| 选项 | ① | ② | ②中实验现象和反应类型 | 实验装置 |
| A | 苯 | 溴水 | 溴水橙色褪去,液体分层。加成反应 | |
| B | 浓盐酸 | 浓硫酸 | 产生大量白雾。物理变化 | |
| C | 双氧水 | MnO2 | 产生大量气泡。分解反应 | |
| D | 浓硝酸 | 铜粉 | 产生红粽色气体。氧化还原反应 |
 Fe
Fe  FeCl3
B . H2O2
FeCl3
B . H2O2  H2
H2  H2O
C . CaCl2溶液
H2O
C . CaCl2溶液  CaCO3
CaCO3  CO2
D . CuSO4溶液
CO2
D . CuSO4溶液  Cu
Cu  CuO
CuO
 Fe
Fe  FeCl3
B . H2O2
FeCl3
B . H2O2  H2
H2  H2O
C . CaCl2溶液
H2O
C . CaCl2溶液  CaCO3
CaCO3  CO2
D . CuSO4溶液
CO2
D . CuSO4溶液  Cu
Cu  CuO
CuO
-
(1) 下列物质:①H2O2 ②CO2 ③Na2O ④Ba(OH)2 ⑤MgCl2 ⑥NH4Cl ⑦H2SO4 ⑧C2H5OH(酒精)。(用序号作答)
按组成进行分类,酸有,碱有,盐有;
-
(2) 写出②与④反应的化学方程式:
-
(3) 利用上述物质写出酸碱中和反应的方程式:
-
(4) 利用上述物质写出实验室制备氧气的方程式:
-
(5) (Ⅱ)Fe(OH)3胶体是中学常见的胶体,某课外兴趣小组制备了Fe(OH)3胶体,并探究其性质。
制备方法:将几滴滴入中,继续煮沸至液体变为色,停止加热,可得到Fe(OH)3胶体,制备的化学方程式为。
-
(6) 某同学向制备好的Fe(OH)3胶体中逐滴加入稀硫酸,结果出现了一系列变化,首先看到,原因是,随后看到,这时发生的化学方程式为。
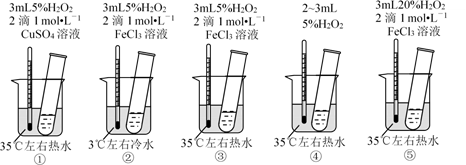
-
(1) 为探究温度对化学反应速率的影响,应选择实验(填序号,下同) ,选择的依据是。
-
(2) 为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验。
-
(3) 通过观察发现实验⑤比实验③现象明显,其原因是。
-
(4) 根据上述实验,用H2O2快速制取少量O2 , 可采取的三条措施为。
| 选项 | X | Y | Z | 实验现象或结论 | 装置 |
| A | 稀硫酸 | 亚硫酸钠 | 品红溶液 | | |
| B | 双氧水 | | 氢硫酸溶液 | 产生浑浊 | |
| C | 浓盐酸 | 石灰石 | 硅酸钠溶液 | 非金属性: | |
| D | 浓硝酸 | | 水(含酚酞) | 试管中液体变红 |
 ,下列说法错误的是( )
,下列说法错误的是( )
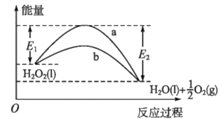
 O2(g)时,能量降低
D . 加催化剂后,正反应速率加快,逆反应速率减小
O2(g)时,能量降低
D . 加催化剂后,正反应速率加快,逆反应速率减小
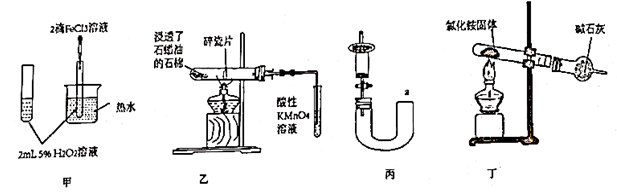
 对
对  分解反应有催化作用
B . 用装置乙验证石蜡油分解的产物只有乙烯
C . 用装置丙从a处加水的方法检验气密性
D . 用装置丁制取氨气
分解反应有催化作用
B . 用装置乙验证石蜡油分解的产物只有乙烯
C . 用装置丙从a处加水的方法检验气密性
D . 用装置丁制取氨气
| 选项 | 实验操作和现象 | 结论 |
| A | 向H2O2溶液中滴加少量KMnO4溶液,紫红色褪去 | H2O2具有氧化性 |
| B | 将二氧化硫气体通入品红溶液,品红溶液褪色 | 二氧化硫具有漂白性 |
| C | 向蔗糖中滴入浓硫酸,固体变黑膨胀 | 浓硫酸具有吸水性 |
| D | AgCl悬浊液中滴入稀KI溶液,有黄色沉淀出现 | KSPAgI > KSPAgCl |
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有 |
| B | 用pH试纸测定浓度均为0.1mol·L-1HCOONa溶液与CH3COONa溶液的pH,CH3COONa溶液的pH较大 | CH3COOH电离出H+的能力比HCOOH的强 |
| C | 向0.1mol·L-1H2O2溶液中滴加0.1mol·L-1KMnO4溶液,溶液褪色并放出能使带火星木条复燃的气体 | H2O2具有氧化性 |
| D | 向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡,出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |

 能氧化品红
能氧化品红