工业合成氨 知识点题库
 2NH3
B . 铝:2Al2O3(熔融)
2NH3
B . 铝:2Al2O3(熔融) 4Al+3O2↑
C . 氯气:MnO2+4HCl(浓)
4Al+3O2↑
C . 氯气:MnO2+4HCl(浓)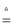 MnCl2+Cl2↑+2H2O
D . 硫酸:2SO2+O2
MnCl2+Cl2↑+2H2O
D . 硫酸:2SO2+O2 2SO3 , SO3+H2O═H2SO4
2SO3 , SO3+H2O═H2SO4
-
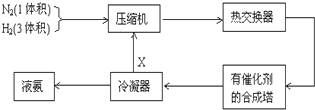
(1) 工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法,;
-
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称,其中发生的化学反应方程式为;
-
(3) 设备B的名称;
-
(4) 设备C的作用.
已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890kJ•mol﹣1
2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJ•mol﹣1
2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJ•mol﹣1
-
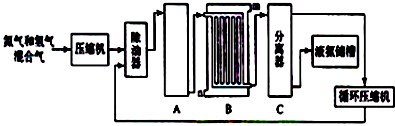
(1) 请写出CH4(g)与O2(g)反应生成CO(g)和H2(g)的热化学反应方程式.
-
(2) 在生产过程中,会涉及H2和CO2的分离.你认为可取的方法是(填序号).
a.在加压条件下用水吸收CO2 b.用NaOH溶液吸收CO2 c.加压,使CO2液化
-
(3) 合成尿素的反应是分作两步进行的:
①CO2(g)+2NH3(g)═H2NCOONH4(aq) (氨基甲酸铵)△H=﹣159.47kJ•mol﹣1
②H2NCOONH4(aq)═CO(NH2)2(aq)+H2O(l)△H=﹢28.49kJ•mol﹣1
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图2所示.生产过程中n(NH3):n(CO2)的最佳配比为,而实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为、.在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是.
-
(4) 将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3 . 若HNO3与NH3的反应是完全的,有标准状况下50LNH3经上述反应过程生成84g NH4NO3 . 则NH3逐级转化为HNO3的转化率为.
 2NH3 , 回答下列问题:
2NH3 , 回答下列问题:
-
(1) 反应过程中拆开的化学键是;
-
(2) 反应放热,从价键角度分析,反应放热的原因是,下列图像正确的是。
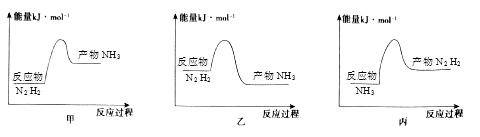
-
(3) 在体积是2L的密闭容器中开始加入1molN2 , 3molH2 , 反应过程浓度中,物质的浓度与时间的关系如图所示。
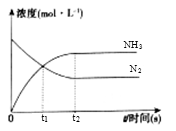
①t1时生成NH3的物质的量是;用H2表示的化学反应速率υ(H2)=。
②下列各项能表明反应达到化学平衡状态的是。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH-H键同时形成6molN-H键
-
(4) 下列措施中能提高合成氨反应化学反应速率的是。
A.使用高效催化剂
B.恒温恒容再充入氢气
C.降低反应温度
D.扩大容器体积
-
(1) I.氨是一种重要的工业原料。回答下列问题:
催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式;该反应中氧化产物与还原产物的物质的量之比为。
-
(2) 当运输氨气的管道发生泄漏时,可用一种挥发性液体(写试剂名称) 进行检查,出现的现象是。
-
(3) II.联氨(N2H4)具有较强的还原性。工业上用过量氨气和NaClO溶液来制备。
制取NaClO所用的原料是、。解释氨气过量的原因。常温下,向10mL pH=2的盐酸中滴加等浓度氨水。加入氨水的体积(V)与溶液pH的关系如图所示。
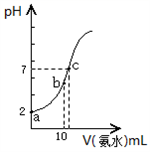
-
(4) a点溶液中由水电离产生的c(H+)10-7mol/L (填>、<或=);用平衡移动原理解释b点溶液呈酸性的原因。
-
(5) 比较c点溶液中所有离子浓度大小关系是。
 2NH3(g)。
2NH3(g)。
-
(1) 德国化学家F•Haber利用N2和H2在催化剂表面合成氨气而获得诺贝尔奖,该反应的能量变化及微观历程的示意图如图,用
 、
、 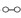 、
、 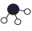 分别表示N2、H2、NH3。
分别表示N2、H2、NH3。 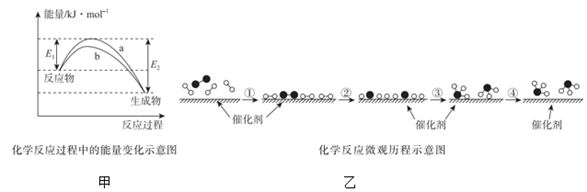
①该反应是(填“吸热”或“放热”)反应,其原因是反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。
②关于N2和H2在催化剂表面合成氨气的过程,下列说法正确的是(填序号)。
A.图甲中曲线a表示有催化剂时的能量变化情况
B.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
C.在图乙②过程中,N2、H2断键形成氮原子和氢原子
D.使用催化剂可以使生成的氨气的量增多
-
(2) 一定温度下,向恒容的密闭容器中充入一定量的N2和H2发生反应,测得各组分浓度随时间变化如图所示。
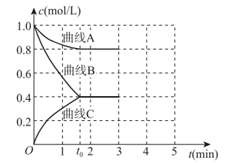
①表示c(N2)变化的曲线是(填“A”“B”或“C”)。
②0~t0时用H2表示的化学反应速率:v(H2)=mol·L-1·min-1。
③下列能说明该反应达到平衡状态的是(填序号,可多选)。
a.容器中的压强不随时间变化
b.2c(H2)=3c(NH3)
c.容器中混合气体的密度不随时间变化
d.断裂3molH—H键的同时断裂6molN—H键
-
(3) 人们曾认为N2+3H2
 2NH3化学反应速率小,原材料利用率低,不可能用于工业化催化剂生产。化学家们不断地研究和改进该反应的条件,如催化剂、温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。下列反应条件的改变对反应速率的影响正确的是___(填序号)。
A . 增大N2的浓度能加快反应速率 B . 充入稀有气体增大压强能加快反应速率 C . 升高温度能减慢反应速率 D . 使用催化剂对反应速率无影响
2NH3化学反应速率小,原材料利用率低,不可能用于工业化催化剂生产。化学家们不断地研究和改进该反应的条件,如催化剂、温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。下列反应条件的改变对反应速率的影响正确的是___(填序号)。
A . 增大N2的浓度能加快反应速率 B . 充入稀有气体增大压强能加快反应速率 C . 升高温度能减慢反应速率 D . 使用催化剂对反应速率无影响

下列关于合成氨反应的叙述中错误的是( )
-
(1) 在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24 kJ的热量,写出该可逆反应的热化学方程式:。在图中画出合成氨反应过程中焓(H )的变化示意图。
-
(2) 将N2和H2通入体积为2 L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2 mol/L,这段时间内用N2的浓度变化表示的化学反应速率为mol/(L·min)。
-
(3) 理论上,为了增大平衡时H2的转化率,可采取的措施是(写出一条)。
-
(4) 图为某压强下N2和H2按物质的量之比1∶3投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是____。
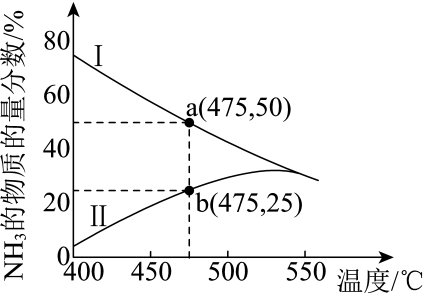 A . 图中a点,容器内n(N2)∶n(NH3)=1∶4 B . 图中b点,υ正<υ逆 C . 400~530 ℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
A . 图中a点,容器内n(N2)∶n(NH3)=1∶4 B . 图中b点,υ正<υ逆 C . 400~530 ℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大



