工业合成氨 知识点题库
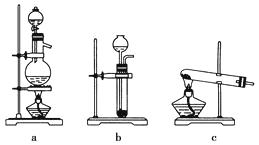
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
-
(1) 从上图中选择制取气体的合适装置:氮气、氢气。
-
(2) 氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。
-
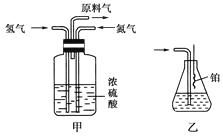
(3) 氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸;原因是。
-
(4) 用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是,
锥形瓶中还可观察到的现象是。
-
(5) 写出乙装置中氨氧化的化学方程式:。
-
(6) 反应结束后锥形瓶内的溶液中含有H+、OH-、、。
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证.
Ⅰ.氮的化合物是重要的化工产品.其生产方法也在逐渐改进中,各国科学家均在为提高其产量,降低能耗做各种有益的探究.
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g)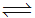 2NH3(g),△H=﹣92.4kJ/mol. 在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ.其原因是 .
2NH3(g),△H=﹣92.4kJ/mol. 在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ.其原因是 .
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率.从化学反应本质角度分析,电磁场对合成氨反应的作用是 ;与传统的合成氨的方法比较,该方法的优点是 .
Ⅱ.(1)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
d.将MgCl2•6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg.
①步骤d中的“一定条件”指的是 .
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(2)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+ , 而不吸附其他元素.其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为: .
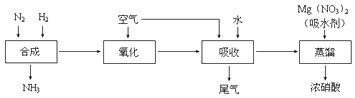
①写出工业合成氨的化学方程式,上述尾气中的NO一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为.
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有.
 2NH3
2NH3
-
(1) 反应物在催化剂表面的吸附过程是 (填“吸热”或“放热”)。
-
(2) 合成氨的热化学方程式为。升温该反应的平衡常数(填“增大”或“减小”)。
-
(3) t ℃时,向2 L的恒容密闭容器中充入2 mol N2和6 mol H2 , 反应过程中对NH3的物质的量进行监测,得到的数据如表所示:
时间/min
5
10
15
20
25
30
n(NH3)/mol
1.4
2.0
2.4
2.6
2.6
2.6
①10 min内,消耗N2的平均反应速率为,该温度下反应的化学平衡常数K=(mol·L-1)-2(列出计算式即可)。
②若改变某一条件,达到新平衡时使NH3的体积分数增大,下列措施可行的是。
A.向容器中再通入一定量的H2气体
B.升高容器的温度
C.加入合适的催化剂
D.缩小容器的体积
③当上述反应达到平衡后,只改变某一条件,下列措施能提高N2转化率的是。
A.将混合气体降温使氨气液化
B.按原物质的量之比1∶3再通入一定量的N2和H2
C.通入一定量的N2
D.通入一定量的惰性气体
-
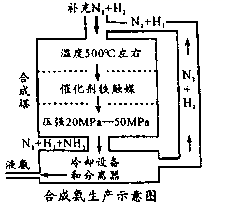
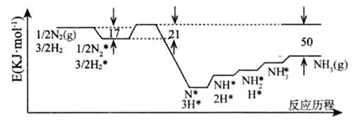
(1) 科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。
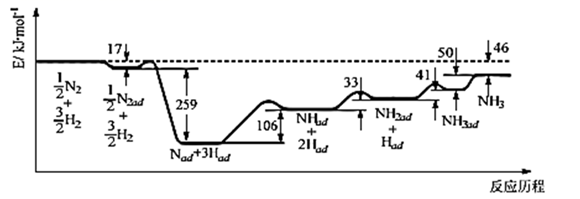
写出合成氨的热化学方程式:;该反应历程中最大能垒对应的化学方程式为:。
-
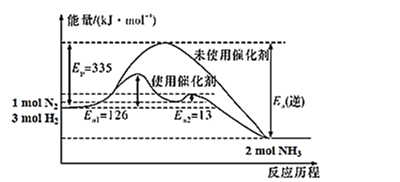
(2) 如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=kJ·mol-1;使用催化剂之后,正反应的活化能为kJ·mol-1。
-
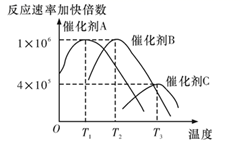
(3) 合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是(填“A”“B”或“C”),理由是。
-
(4) 一定温度下,将1mol N2和3 mol H2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=(用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
-
(5) 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:
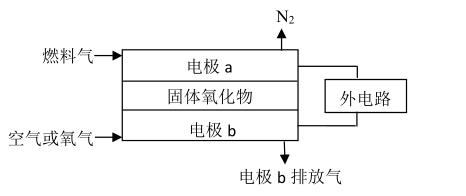
①固体氧化物电池工作的电解质,O2-移向(填字母)。
A 电极a B 电极b
②该电池工作时,电极a上发生的电极反应为。
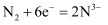 B . 过程Ⅱ生成W的反应:
B . 过程Ⅱ生成W的反应: 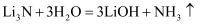 C . 过程Ⅲ中LiOH在阳极得电子生成金属锂,该体系中可用金属锂作阳极材料
D . 过程Ⅲ中阴极电极反应式为
C . 过程Ⅲ中LiOH在阳极得电子生成金属锂,该体系中可用金属锂作阳极材料
D . 过程Ⅲ中阴极电极反应式为 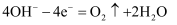
 )”是化学工业常用的原料气,请回答:
)”是化学工业常用的原料气,请回答:
-
(1) I.已知:焦炭、CO的标准燃烧热分别为
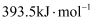 、
、 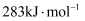 ,氢气燃烧的热化学反应方程式:
,氢气燃烧的热化学反应方程式: 
试写出由焦炭和水蒸气生成水煤气的热化学反应方程式:
-
(2) 下列说法正确的是___________A . 将煤炭在空气中直接加强热进行干馏,制备生成水煤气的原料焦炭 B . 水煤气可经过催化合成获得液体燃料、碳氢化合物和含氧有机物 C . 水煤气也可采用高温下煤和水蒸气直接作用制得 D . 在恒压反应釜中,利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气的流速,有利于水煤气的生成
-
(3) II.合成氨工厂以“水煤气”为原料,采用两段间接换热式绝热反应器(反应器中的催化剂对原料气的吸附时间长短,对原料气的转化率会造成一定影响)在常压下进行转换合成氨,装置如图。

A反应器中主要发生的反应为:

B反应器中主要发生的反应为:
主反应:

副反应:
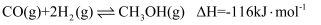
由进气口充入一定量含CO、
 、
、  、
、  的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、
的混合气体,在B中充分反应,在T℃下,反应达到平衡后,测得混合气体各组分的物质的量分别为CO0.2mol、 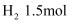 、
、 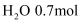 、
、 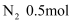 、
、 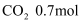 和
和 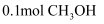 。
。已知标准平衡常数:
 ,其中
,其中  表示标准压强(
表示标准压强(  )
)  、
、 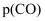 、
、  、
、  表示各组分的分压,如
表示各组分的分压,如  ,
, 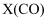 为体系中CO的物质的量分数
为体系中CO的物质的量分数T℃时,主反应的压强平衡常数

-
(4) 平衡时CO的转化率为
-
(5) 进气空速对反应产品的收率有一定的影响,实验测得在不同进气空速下,测得平衡时
 的收率如下图所示
的收率如下图所示 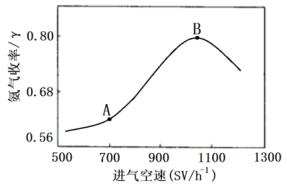
①曲线中A点到B点变化的原因是:
②若将绝热转换反应器改为恒温转换反应器,试在图中画出随进气空速变化的
 收率曲线。
收率曲线。

-
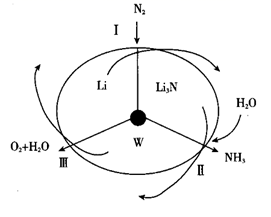
(1) 如图所示氮循环中,属于氮的固定的有(填字母序号)。
a.
 转化为铵态氮 b.硝化过程 c.反硝化过程
转化为铵态氮 b.硝化过程 c.反硝化过程 -
(2) 氮肥是水体中铵态氮的主要来源之一。
①氨气是生产氮肥的主要原料,工业合成氨的化学方程式为。
②检验铵态氮肥中
 的实验方案是。
的实验方案是。 -
(3) 铵态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移的电子的物质的量为mol。
-
(4) 常温下氨气能被氯气氧化生成
 ,化工厂常用此法检验管道是否泄漏氯气,某研究小组用下面装置进行氨气的制备并验证氨气与氯气反应。
,化工厂常用此法检验管道是否泄漏氯气,某研究小组用下面装置进行氨气的制备并验证氨气与氯气反应。 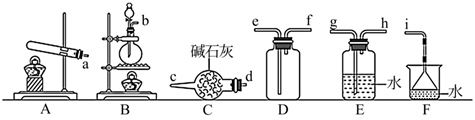
Ⅰ.氨气的制备。欲制备和收集一瓶干燥的氨气可以选择图中的装置(填大写字母)。
Ⅱ.氯气与氨气的反应(已知:实验前
 、
、  关闭)。
关闭)。
①打开
 ,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭
,缓缓推动注射器活塞,向试管中注入约3倍于氯气体积的氨气,关闭  ,恢复至室温。试管中可观察到的现象是。发生反应的化学方程式。
,恢复至室温。试管中可观察到的现象是。发生反应的化学方程式。②再打开
 ,可观察到的现象是。
,可观察到的现象是。
-
(1) 方法I:氨热分解法制氢气
已知该反应为可逆反应,在一定温度下,利用催化剂将
 分解为
分解为 和
和 的化学方程式为。
的化学方程式为。 -
(2) 该反应为吸热反应,说明反应物的总能量生成物的总能量(填“大于”“小于”或“等于”)。
-
(3) 在一定温度和催化剂的条件下,向
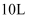 容积固定的密闭容器中充入
容积固定的密闭容器中充入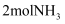 发生该反应,
发生该反应,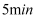 末测得容器中
末测得容器中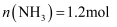 , 则在
, 则在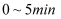 内,用
内,用 的浓度变化表示该反应的平均速率是:
的浓度变化表示该反应的平均速率是:
 。
。
-
(4) 该反应达到化学平衡的标志是____(填序号)。A .
 的浓度为0
B .
的浓度为0
B .  的物质的量保持不变
C . 正反应速率与逆反应速率相等
D .
的物质的量保持不变
C . 正反应速率与逆反应速率相等
D .  的物质的量之比为
的物质的量之比为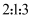
-
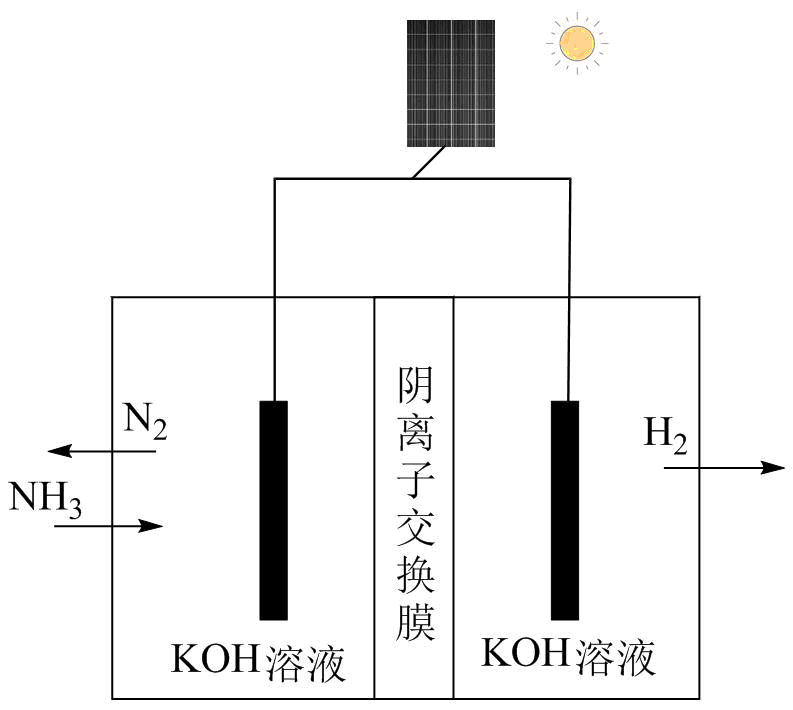
(5) 方法II:氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。装置中将太阳能转化为电能的电池,其主要材料是。装置中生成
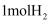 时,电路中通过
时,电路中通过 电子。为提高制取氢气的反应速率,可采取的方法是。
电子。为提高制取氢气的反应速率,可采取的方法是。