氢键的存在对物质性质的影响 知识点题库
下列现象与氢键有关的是( )
①NH3的熔、沸点比第ⅤA族其他元素氢化物的高 ②小分子的醇和羧酸易溶于水 ③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A . ①②③④⑤⑥
B . ①②③④⑤
C . ①②③④
D . ①②③
下列物质的酸性强弱比较中,错误的是( )
A . HClO4>HBrO4>HIO4
B . HClO4>H2SO4>H3PO4
C . HClO4>HClO3>HClO
D . H2SO3>H2SO4>H2S2O3
下列说法中不正确的是( )
A . H2O的沸点比较高,是由于水分子间存在氢键的原因
B . 除稀有气体外的非金属元素都能生成不同价态的含氧酸
C . 若ⅡA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数可能为m+11
D . 由于分子间作用力比化学键弱得多,所以干冰升华容易,而CO2气体分解却不易
科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.
-
(1) 鉴别某种金属互化物是晶体还是非晶体的方法是.
-
(2) 已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因.
-
(3) 镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是,σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是.
-
(4) 立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b g•cm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为.

下表为元素周期表前三周期的一部分:

-
(1) X的氢化物的沸点与W的氢化物的沸点比较:>(填化学式),原因是。
-
(2) X的基态原子的电子排布图为(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合。

-
(3) 以上五种元素中,(填元素符号)的第一电离能最大。
-
(4) 由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如图所示,则下列判断错误的是 。
 A . G是最活泼的非金属单质 B . L是极性分子 C . E的中心原子的杂化轨道类型为sp2杂化 D . M的化学性质比同周期相邻元素单质的化学性质活泼 E . M分子中有1个σ键,2个π键
A . G是最活泼的非金属单质 B . L是极性分子 C . E的中心原子的杂化轨道类型为sp2杂化 D . M的化学性质比同周期相邻元素单质的化学性质活泼 E . M分子中有1个σ键,2个π键
第二周期除Be、B、N、Ne四种元素外,其他元素的氢化物的沸点为:a.1 317 ℃ b.100 ℃ c.19.5 ℃ d.-162 ℃。则c的化学式为( )
A . LiH
B . CH4
C . H2O
D . HF
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;X与M同主族; Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
-
(1) 元素Y在周期表中的位置。
-
(2) Z、M、N三种元素简单离子半径由大到小的顺序是(用元素符号表示)。
-
(3) X与Z能以原子个数比2:1和1:1形成两种化合物,其中既含极性键又含非极性键的化合物的电子式为。
-
(4) Z的简单氢化物比同族元素的简单氢化物沸点(“高”或“低”),原因是。
-
(5) 元素Z和M在常温下可以直接化合,用电子式表示其形成过程。
-
(6) 由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A
 B(在水溶液中进行) , 其中,C是溶于水显酸性的气体;D是淡黄色固体。
B(在水溶液中进行) , 其中,C是溶于水显酸性的气体;D是淡黄色固体。①写出C的结构式:;
②如果A、B均由三种元素组成,且B为两性不溶物。则A和过量的C反应生成B的离子方程式为。
原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请你回答下列问题:
-
(1) 请按要求任意写一个相应物质:(填化学式)含有非极性键的离子化合物,既含有非极性键又含极性键的非极性分子,既含有非极性键又含极性键的极性分子,全部由非金属元素组成的离子化合物,由金属元素和非金属元素组成的共价化合物。
-
(2) 苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ的分子结构如图所示。


苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图所示的结构,则其在水中的溶解度会(填“增大”或“减小”),原因是。
-
(3) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为,由Cl-所形成的化学键类型是。
-
(4) 下图中A,B,C,D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是;表示ⅣA族元素氢化物沸点的曲线是;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是;A,B,C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是。

下列说法错误的是( )
A . 甘油和水可以任意比例互溶
B . H2O的沸点高于HF, 是因为前者的氢键作用较大
C . 氢氟酸水溶液中氢键的类型有 F—H•••F、F—H•••O、O—H•••F、O—H•••O
D .  比
比  熔点低的原因是前者形成分子内氢键
熔点低的原因是前者形成分子内氢键
 比
比  熔点低的原因是前者形成分子内氢键
熔点低的原因是前者形成分子内氢键
-
(1) 酸性强弱比较:苯酚碳酸(填“>”、“=”或“<”),原因(用相应的离子方程式表示):。
-
(2) 沸点:H2OH2S(填“>”、“=”或“<”),原因。
-
(3) 实验室欲测定Na2CO3和NaCl混合物中Na2CO3的质量分数ω(Na2CO3),实验步骤如下:称取此固体样品4.350g,溶于适量的水中,配成50mL溶液。取出25mL溶液,加入足量的AgNO3溶液充分反应,得到沉淀的质量为5.575g.则原混合物中ω(Na2CO3)=(保留4位有效数字)。写出简要的计算过程。
下列说法正确的是( )
A . 氢氧化钠固体中存在离子键和非极性键
B . 氯化氢的电子式为 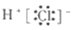 C . 干冰熔化破坏了共价键和分子间作用力
D . 水的沸点比硫化氢的沸点高是因为水分子之间存在氢键
C . 干冰熔化破坏了共价键和分子间作用力
D . 水的沸点比硫化氢的沸点高是因为水分子之间存在氢键
表中所列的字母分别代表某一种化学元素,下列说法正确的是( )

A . 沸点A2D<A2X
B . CA3分子是非极性分子
C . B、C、D形成的气态氢化物互为等电子体
D . C形成的单质中σ键与π键个数之比为1∶2
白磷(P4)易自燃,易溶于CS2 , Ca(H2PO4)2是磷肥的有效成分;砷化镓是重要的半导体材料。下列关于氮、磷、砷的单质及化合物的说法正确的是( )

A . 磷肥与草木灰混合施肥效果更佳
B . 肼的沸点为113.5℃,说明肼分子间可能存在氢键
C . 白磷分子(P4)是极性分子,白磷可保存在水中
D . 砷化镓的晶胞结构如上图所示,镓原子配位数为8
羟氨(  )可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )
)可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )
 )可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )
)可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )
A . 羟氨易溶于水是由于其与水分子形成分子间氢键
B . 羟氨既有氧化性又有还原性
C . 羟氨的水溶液显碱性,可与盐酸发生反应
D . 羟氨分子中  原子、
原子、  原子与羟基
原子与羟基  原子共线
原子共线
 原子、
原子、  原子与羟基
原子与羟基  原子共线
原子共线
推广磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺( )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。
 )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。回答下列问题:
-
(1) 基态铁原子核外电子运动状态有种;基态Fe3+较基态Fe2+稳定的原因是。
-
(2) 在NH4H2PO4中的N、P、O三种元素的电负性由大到小的顺序是;NH
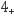 的空间构型为;H2PO
的空间构型为;H2PO 中P原子的杂化轨道类型为。
中P原子的杂化轨道类型为。
-
(3) 1mol
 中含有molσ键;苯胺水溶性大于苯的主要原因是。
中含有molσ键;苯胺水溶性大于苯的主要原因是。
-
(4) 构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。

①石墨的硬度小、熔沸点高的原因分别是。
②如图晶体的化学式为;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为g•cm-3(用NA表示阿伏加德罗常数,列式即可)。
下列“类比”合理的是( )
A . Fe3O4中Fe元素显+2、+3价,则Pb3O4中Pb显+2、+3价
B . SiH4的沸点比CH4高,则PH3的沸点比NH3高
C . 向Fe(OH)3中加入盐酸生成Fe3+ , 则向Fe(OH)3中加入氢溴酸也生成Fe3+
D . Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应生成Na2SO3和O2
下列说法正确的是( )
A . 标准状况下,HF呈液态,NH3呈气态,原因是HF分子间存在氢键,而NH3分子间只存在范德华力
B . H2S的分解温度高于H2Se,原因是H—S键的键能大于H-Se键
C . 用浓氨水可以除去Mg(OH)2中的少量Cu(OH)2 , 原因是Cu(OH)2与NH3形成较稳定的[Cu(NH3)4]2+
D . 北京冬奥会采用CO2作制冷剂,原因是断裂共价键需要吸收大量的热量
科学家最近研制出有望成为高效火箭推进剂的新物质三硝基胺 , 其结构如图所示。已知该分子中
, 其结构如图所示。已知该分子中 键角都是108.1°,下列有关说法不正确的是( )
键角都是108.1°,下列有关说法不正确的是( )
 , 其结构如图所示。已知该分子中
, 其结构如图所示。已知该分子中 键角都是108.1°,下列有关说法不正确的是( )
键角都是108.1°,下列有关说法不正确的是( )
A . 分子中N、N间形成的共价键是非极性键
B . 该分子易溶于水,是因为分子中N、O均能与水分子形成氢键
C . 分子中非硝基氮原子采取 杂化
D . 分子中非硝基氮原子上有1对孤对电子
杂化
D . 分子中非硝基氮原子上有1对孤对电子
 杂化
D . 分子中非硝基氮原子上有1对孤对电子
杂化
D . 分子中非硝基氮原子上有1对孤对电子
下列说法正确的是( )
A . 次氯酸的结构式为:H-Cl-O
B . 虚线表示邻烃基苯甲醛的分子间氢键: C . 醛基的碳氧双键有极性:
C . 醛基的碳氧双键有极性: D . 组成天然蛋白质的氨基酸可以表示为
D . 组成天然蛋白质的氨基酸可以表示为
 C . 醛基的碳氧双键有极性:
C . 醛基的碳氧双键有极性: D . 组成天然蛋白质的氨基酸可以表示为
D . 组成天然蛋白质的氨基酸可以表示为 是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如
是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如 、
、 等),并能将它们转化为
等),并能将它们转化为 和
和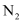 等小分子物质。
等小分子物质。
-
(1)
 基态核外电子排布式为。
基态核外电子排布式为。
-
(2) 甲苯中C原子轨道杂化类型为。
-
(3) 氨气极易溶于水,除因为它们都是极性分子外,还因为。
-
(4) 含
 的污水毒性极大,用
的污水毒性极大,用 先将
先将 氧化为
氧化为 后在酸性条件下再将
后在酸性条件下再将 氧化为无污染的气体,则与
氧化为无污染的气体,则与 互为等电子体的分子为。
互为等电子体的分子为。
-
(5) 某含钛配合物,化学式为
 ,
, 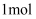 该配合物中
该配合物中 键的数目为。
键的数目为。
最近更新



