化学反应速率 知识点题库
Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2 , 试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率
(2)为了提高生成SO2的速率,可以采取的措施是
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
(3)该反应的化学方程式为
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.

-
(1) 用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ/mol
③H2O(g)=H2O(l) △H= -44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式。
-
(2) 已知:反应I:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0 反应II:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0①在恒温恒容装置中充入一定量的NH3 和O2 , 在催化剂的作用下进行反应I,则下列有关叙述中正确的是(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大
B.若测得容器内3v(NH3)=2v (H2O)时,说明反应已达平衡
C.通入一定量的氮气,则化学反应速率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2 , 得有关物质的量关系如图,该催化剂在低温时选择反应(填“I”或“II”)。

③520℃时,4NH3(g)+3O2(g)
 2N2(g)+6H2O(g)的平衡常数K=(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有( 填字母序号)
2N2(g)+6H2O(g)的平衡常数K=(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有( 填字母序号)A.降低反应温度
B. 投料比不变,增加反应物的浓度
C.增大NH3和O2的初始投料比
D. 充入一定量的氦气
-
(3) 已知25℃时HCN 和H2CO3的电离常数(Ka.)如下表:
物质
电离常数(Ka)
HCN
Ka=5×10-10
H2CO3
Ka1=4.5×10-7;Ka2=4.7× 10-11
25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则c(Na+)、c(H+)、c(CN-)、c(OH-)、c(HCN)浓度由大到小顺序为,向NaCN溶液中通入少量CO2 , 则发生反应的化学方程式为:。
 2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是( )
2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是( )
 2NH3 中,经一段时间后,氨的浓度增加了0.6 mol·L−1 , 在此时间内用H2表示的平均反应速率为0.45 mol·(L·s) -1。则反应所经过的时间为( )
2NH3 中,经一段时间后,氨的浓度增加了0.6 mol·L−1 , 在此时间内用H2表示的平均反应速率为0.45 mol·(L·s) -1。则反应所经过的时间为( )
-
(1) 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。 
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)。
②该反应的平衡常数表达式为K=。
③下列措施中能使n(CH3OH)/n(CO2)增大的是。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
-
(2) 有人提出,可以设计反应2CO(g)=2C(s)+O2(g) 通过其自发进行来消除CO的污染。该方案(填“是”、“否”)可行,理由是:。
 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( ) | t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
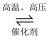 2NH3 , 经过一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol·L-1·s-1。则这段时间为( )
2NH3 , 经过一段时间后,NH3的物质的量增加0.8mol,在这段时间内用N2表示的平均反应速率为0.01mol·L-1·s-1。则这段时间为( )

 B . 反应进行到1s时,
B . 反应进行到1s时,  C . 反应进行到6s时,B的平均反应速率为
C . 反应进行到6s时,B的平均反应速率为  D . 反应进行到6s时,各物质的反应速率相等
D . 反应进行到6s时,各物质的反应速率相等
 (
( 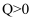 ),反应达到平衡后,
),反应达到平衡后, 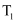 时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是( )
时缩小容器体积,x随时间(t)变化的关系如图所示。x不可能是( ) 
 浓度)
浓度)


-
(1) 由图中所给数据进行分析,该反应的化学方程式为。
-
(2) 下列措施能加快反应速率的是__________________(填字母)。A . 恒压时充入He B . 恒容时充入He C . 恒容时充入A D . 及时分离出C E . 升高温度 F . 选择高效的催化剂
-
(3) 能说明该反应已达到平衡状态的是______________(填字母)。A . 单位时间内生成n mol A,同时消耗n mol C B . 容器内,3种气体A,B,C共存 C . C的消耗速率等于A的消耗速率 D . 容器内压强保持不变 E . 容器中各组分的体积分数不随时间变化
-
(4) 反应从开始至2min,用A的浓度变化表示的平均反应速率v(A)为。
 mol(L•s)
D . 12s后将容器体积扩大为10L,Z的平衡浓度变为原来的
mol(L•s)
D . 12s后将容器体积扩大为10L,Z的平衡浓度变为原来的 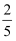
 2NH3(g),至5min时,反应达到平衡状态,测得生成NH30.4mol。
2NH3(g),至5min时,反应达到平衡状态,测得生成NH30.4mol。回答下列问题:
-
(1) NH3中含有的化学键类型为(填“离子键”或“共价键”)。
-
(2) 下列外界条件的改变,能增大该反应速率的有(填标号)。
a.适当升高温度 b.充入少量氩气以增大压强
c.充入少量N2 d.将氨气液化分离
-
(3) 第6min时,正、逆反应速率的大小关系为v正v逆(填“>“<”或“=”)。
-
(4) 0~5min内,用H2的浓度变化来表示该反应的平均反应速率v(H2)=。平衡时,N2的转化率为。
-
(5) 能判断该反应达到化学平衡状态的依据是(填标号)。
a.2v(H2)正=3v(NH3)逆
b.c(N2):c(H2)=1:3
c.生成2molNH3的同时反应1molN2
d.混合气体的平均相对分子质量不变



