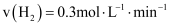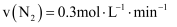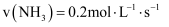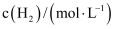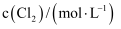化学反应速率 知识点
化学反应速率 知识点题库
①CH4(g)+H2O(g)=CO(g)+ 3H2(g) △H1= + 206.2 kJ/ mol
②CO(g)+2H2(g)=CH3OH(g) △H2=- 90.1kJ/ mol
③2CH3OH(g) = CH3OCH3(g) + H2O(g) △H3=- 24.5kJ/ mol
④2CH3OH(g)  C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
⑤CH3OCH3(g)== C2H5OH(g) △H5=- 50.7 kJ /mol
请回答下列问题:
-
(1) 反应2CH4(g)+H2O(g)= C2H5OH(g)+2H2(g)的△H =kJ/mol;根据化学原理,可以同时加快该反应的速率和提高甲烷转化率的措施有。

-
(2) CO与H2在一定条件下,同时发生②和③的反应,产生二甲醚的结果如上图所示。260℃时,CO转化率虽然很高,而二甲醚的产率却很低,可能的原因是 ( 答出一条即可) ;CO 与H2 合成二甲醚的最佳的温度是。
-
(3) 对于气体参与的反应如反应④[2CH3OH(g)
 C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=。
C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=。
-
(4) 反应①~⑤中有多种物质可以做燃料电池的燃料,其中H2是单位质量燃料释放电能最多的物质,若与下列物质构成电池,H2 与构成的电池比能量最大。
a.H2O2
b.Cl2
c.O2
d.NiOOH
 B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。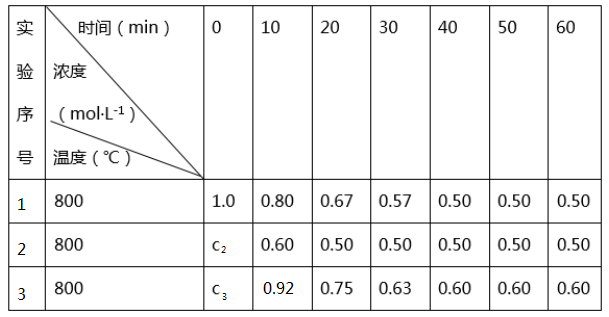
根据上述数据,完成下列填空;
-
(1) 实验1中,10~20min内A的反应速率为mol·L-1min-1.
-
(2) 实验2中,c2=,反应经20min时达到平衡,可推测实验2中还隐含的条件是。
-
(3) 设10~20min内实验3中A的反应速率为v3 , 实验中A的反应速率为v1 , 则v3v1(填“>”“=”或“<”),且c31.0(填“>”“=”或“<”)。
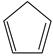 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
-
(1) 已知:
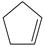 (g) =
(g) = 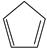 (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ① H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应:
 (g)+ I2(g) =
(g)+ I2(g) = 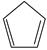 (g)+2HI(g) ③ ΔH3=kJ·mol −1。
(g)+2HI(g) ③ ΔH3=kJ·mol −1。 -
(2) 某温度下,等物质的量的碘和环戊烯(
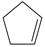 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。 A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
-
(3) 环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
 A . T1>T2 B . a点的反应速率小于c点的反应速率 C . a点的正反应速率大于b点的逆反应速率 D . b点时二聚体的浓度为0.45 mol·L−1
A . T1>T2 B . a点的反应速率小于c点的反应速率 C . a点的正反应速率大于b点的逆反应速率 D . b点时二聚体的浓度为0.45 mol·L−1 -
(4) 环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为
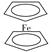 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 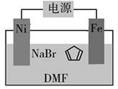
该电解池的阳极为,总反应为。电解制备需要在无水条件下进行,原因为。
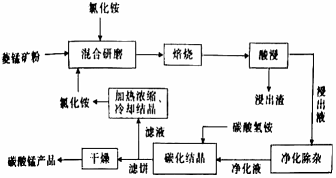
已知:①菱锰矿的主要成分是MnCO3 , 其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
| 离子 | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
| 沉淀完全的pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
③焙烧过程中主要反应为MnCO3+2NH4Cl  MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O
-
(1) 合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4Cl)/c(菱锰矿粉)分别为、、。
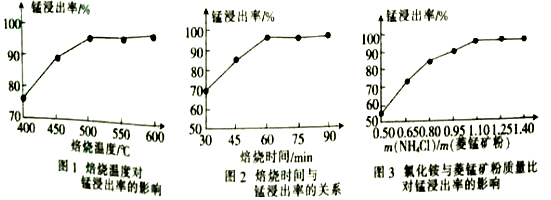
-
(2) 对浸出液净化除杂时,需先加入MnO2 , 作用是,再调节溶液pH的最大范围为,将Fe3+和Al3+变为沉淀面除去,然后加人NH4F将Ca2+、Mg2+变为氧化物沉淀除去。
-
(3) ”碳化结品”步骤中,加入碳酸氢铵时反应的离子方程式为。
-
(4) 上述流程中可循环使用的物质是(填化学式)。
-
(5) 现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500mol•L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500mol•L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为。
②试样中锰的质量分数为。
 2C(g)+2D(g)中,反应速率最快的是( )
2C(g)+2D(g)中,反应速率最快的是( )
 B(g)+D(g)在体积为1L密闭容器中分别在下列四种不同条件下进行,
B(g)+D(g)在体积为1L密闭容器中分别在下列四种不同条件下进行, B、D起始物质的量为0,反应物A的物质的量(mol)随反应时间(min)的变化情况如下表:
| 时间 实验序号 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
-
(1) 实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为mol·L-1·min-1。
-
(2) 实验2中,A的初始浓度C2=mol·L-1 , 反应经20 min就达到平衡,可推测实验2中还隐含的条件是。
-
(3) 设实验3的化学反应速率为υ3 , 实验1的化学反应速率为υ1 , 则υ3 υ1(填“>”“=”或“<”),且C3为mol·L-1。
-
(4) 根据实验数据推测该反应的正反应是反应(填“吸热”或“放热”)
-
(5) 向实验2的平衡体系中充入A、B、D各0.5mol 平衡移动(填“正向”“逆向”或“不”)
 2H2(g)+S2(g)。现在3L密闭容器中进行H2S分解实验。某温度时,测得反应体系中有气体1.31mol,反应10min后,测得气体为1.37mol,则10min内H2的平均生成速率为。
2H2(g)+S2(g)。现在3L密闭容器中进行H2S分解实验。某温度时,测得反应体系中有气体1.31mol,反应10min后,测得气体为1.37mol,则10min内H2的平均生成速率为。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(Cl2)/mol | 0 | 1.2 | 2.6 | 4.4 | 5.4 | 6.0 |

 B(g)+2C(g)
C . t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D . B的起始物质的量为0.04 mol
B(g)+2C(g)
C . t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D . B的起始物质的量为0.04 mol
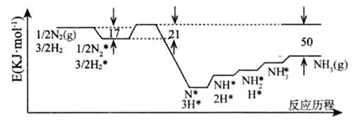
-
(1) 反应物在催化剂表面的吸附过程是 (填“吸热”或“放热”)。
-
(2) 合成氨的热化学方程式为。升温该反应的平衡常数(填“增大”或“减小”)。
-
(3) t ℃时,向2 L的恒容密闭容器中充入2 mol N2和6 mol H2 , 反应过程中对NH3的物质的量进行监测,得到的数据如表所示:
时间/min
5
10
15
20
25
30
n(NH3)/mol
1.4
2.0
2.4
2.6
2.6
2.6
①10 min内,消耗N2的平均反应速率为,该温度下反应的化学平衡常数K=(mol·L-1)-2(列出计算式即可)。
②若改变某一条件,达到新平衡时使NH3的体积分数增大,下列措施可行的是。
A.向容器中再通入一定量的H2气体
B.升高容器的温度
C.加入合适的催化剂
D.缩小容器的体积
③当上述反应达到平衡后,只改变某一条件,下列措施能提高N2转化率的是。
A.将混合气体降温使氨气液化
B.按原物质的量之比1∶3再通入一定量的N2和H2
C.通入一定量的N2
D.通入一定量的惰性气体
-
(1) 氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2
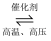 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量(填“大于”或“小于”)生成物化学键形成放出的总能量。 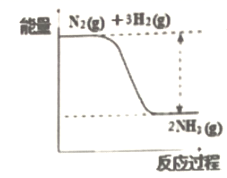
-
(2) 小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)(标准状况)
50
190
414
526
570
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率。(设溶液体积不变)
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子分析:构成的原电池中负极反应式为;溶液中H+移向极(填“正“或“负")。
-
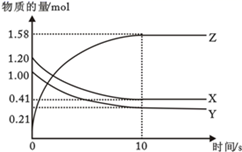
(3) 某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
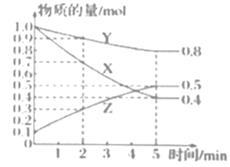
①写出该反应的化学方程式。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为。
| a | b | c | |
| 反应速率 | | | |
则三个容器中合成氨的反应速率由大到小的顺序为( )
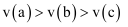 B .
B . 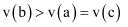 C .
C .  D .
D . 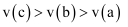
 能发生分解反应:
能发生分解反应:  ,利用该反应可制备氢气和硫黄。在2L恒容密闭容器中充入
,利用该反应可制备氢气和硫黄。在2L恒容密闭容器中充入  ,不同温度下
,不同温度下  的转化率与时间的关系如图所示。下列说法错误的是( )
的转化率与时间的关系如图所示。下列说法错误的是( ) 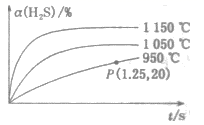
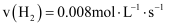 D . 根据P点坐标可求出950℃时反应的平衡常数为
D . 根据P点坐标可求出950℃时反应的平衡常数为 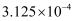
-
(1) 科学家成功研制出一种新型催化剂,能将CO2转变为甲烷。在常压、300℃条件下,CO2与H2按体积之比1∶4反应,CO2转化率可达90%。一定条件下,某兴趣小组在容积为V L的密闭容器中发生此反应达到化学平衡状态。
①该反应的平衡常数表达式为。
②由如图可知该反应的△H0(填“>”、“<”或“=”);300℃时,从反应开始到达平衡,以H2的浓度变化表示的化学反应速率是(用
 、
、  、V表示)。
、V表示)。
-
(2) 已知
 ,
,  ,控制一定条件,该反应能自发进行,则
,控制一定条件,该反应能自发进行,则  0(填“>”,“<”或“=”)。在一定温度下,向一容积可变的容器中充入
0(填“>”,“<”或“=”)。在一定温度下,向一容积可变的容器中充入 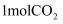 、
、  ,
,  的转化率与反应时间的关系如图所示。在t时加压,若t1时容器容积为1000 mL,则t2时容器容积为mL。
的转化率与反应时间的关系如图所示。在t时加压,若t1时容器容积为1000 mL,则t2时容器容积为mL。 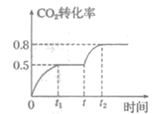
-
(3) 利用回收的
 制取甲醛的反应为
制取甲醛的反应为 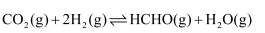
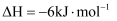
①为提高上述反应中H2的平衡转化率,可以采取的措施有、(任写两条)。
②实验室在2 L恒容密闭容器中模拟上述合成HCHO的实验。
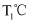 时将
时将 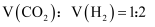 的
的  和
和  混合气体充入容器中,每隔一定时间测得容器内混合气体压强如表所示:
混合气体充入容器中,每隔一定时间测得容器内混合气体压强如表所示:时间/min
0
10
20
30
40
50
60
压强/kPa
1.08
0.96
0.88
0.82
0.80
0.80
0.80
已知:
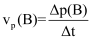 ,即用B物质的分压变化表示
,即用B物质的分压变化表示 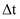 时间内反应的平均反应速率。0~10min内该反应的平均反应速率
时间内反应的平均反应速率。0~10min内该反应的平均反应速率  为
为  。10min时,CO2的转化率为(保留小数点后一位)。
。10min时,CO2的转化率为(保留小数点后一位)。
 的速率方程为
的速率方程为 , k为速率常数(只与温度、催化剂、接触面积有关,与浓度无关),m、n是反应级数,可以是整数、分数。
, k为速率常数(只与温度、催化剂、接触面积有关,与浓度无关),m、n是反应级数,可以是整数、分数。实验测得速率与浓度关系如表所示:
实验 |
|
| 速率 |
① | 0.10 | 0.10 | v |
② | 0.20 | 0.10 | 2v |
③ | 0.20 | 0.40 | 4v |
④ | 0.40 | a | 12v |
下列说法错误的是( )
 D . 表格中,a=0.9
D . 表格中,a=0.9
 的过程中含氮微粒的变化如图所示,溶液中铁以
的过程中含氮微粒的变化如图所示,溶液中铁以 形式存在。下列有关说法错误的是( )
形式存在。下列有关说法错误的是( )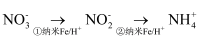
 B . 增大单位体积水体中纳米Fe的投入量,可提高
B . 增大单位体积水体中纳米Fe的投入量,可提高 的除去效果
C . amol
的除去效果
C . amol  完全转化为
完全转化为 至少需要4amol铁
D . 假设反应都能彻底进行,反应①②消耗的铁的物质的量之比为3:1
至少需要4amol铁
D . 假设反应都能彻底进行,反应①②消耗的铁的物质的量之比为3:1
 的两恒容容器中分别充入
的两恒容容器中分别充入 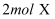 和
和 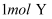 发生反应:
发生反应: 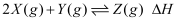 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
 B . 气体的总物质的量:
B . 气体的总物质的量:  C . a点平衡常数:
C . a点平衡常数: 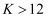 D . 反应速率:
D . 反应速率: 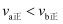
 2Z(g),一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡。反应过程中测定的数据如下表:t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )