化学反应的可逆性 知识点题库
在密闭容器中进行如下反应:X2(气)+Y2(气)⇌2Z(气),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是( )
A . Y2为0.2 mol/L
B . Y2 为0.35 mol/L
C . X2 为0.2 mol/L
D . Z为 0.4 mol/L
向5mL 0.1mol•L﹣1 的KI溶液中滴加5~6滴0.1mol•L﹣1 的FeCl3溶液后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是( )
A . 再滴加AgNO3溶液,观察是否有AgI沉淀产生
B . 加入CCl4振荡后,观察下层液体颜色
C . 再滴加AgNO3溶液,观察是否有AgCl沉淀产生
D . 再滴加KSCN溶液,观察是否有血红色
化学平衡主要研究下列哪一类反应的规律( )
A . 部分反应
B . 任何反应
C . 可逆反应
D . 气体反应
化学平衡的标志
-
(1)
-
(2) .
下列说法正确的是( )
A . 石油的分馏、煤的干馏都是物理变化
B . 化学反应的限度是不可改变的
C . 可用乙醇萃取溴水中的溴
D . 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
下列有关反应限度的说法正确的是( )
A . 大多数化学反应在一定条件下都有一定的限度
B . NH4HCO3受热分解可自发进行:
C . 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
D . FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深
室温下,向圆底烧瓶中加入1molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
 C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
 C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是( )
A . 加入NaOH,可增大乙醇的物质的量
B . 增大HBr浓度,有利于生成C2H5Br
C . 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D . 若起始温度提高至60℃,可缩短反应达到平衡的时间
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A . 78g苯中含有的碳碳双键的数目为3NA
B . 16gCu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C . 将1mol H2与 1 mol I2充入一密闭容器中充分反应后,转移的电子书为2NA
D . 1 mol Fe 与足量的浓硫酸共热反应,生成SO2的分子数为NA
化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是( )
A . 氢气与过量的碘蒸气(500℃)
B . 铝片与过量浓硝酸(常温)
C . 铜粉与过量浓硝酸(常温)
D . 浓硫酸与过量铜片(共热)
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
-
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是。
-
(2) 甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 。
-
(3) 乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。
-
(4) 丙组同学取10mL0.1mol·L-1KI溶液,加入6mL0.1mol· L-1 FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红
实验②检验的离子是(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该氧化还原反应为。
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1 , 将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
2NH3(g) ΔH=-92.0 kJ·mol-1 , 将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
 2NH3(g) ΔH=-92.0 kJ·mol-1 , 将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
2NH3(g) ΔH=-92.0 kJ·mol-1 , 将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
A . 一定小于92.0 kJ
B . 一定大于92.0 kJ
C . 一定等于92.0 kJ
D . 无法确定
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是( )
A . 反应进行的方向
B . 反应的快慢
C . 反应进行的限度
D . 反应物的颜色
下列各组两个反应互为可逆反应的是( )
①2H2+O2  2H2O与2H2O
2H2O与2H2O  2H2↑+O2↑
2H2↑+O2↑
②H2SO4(浓)+2HBr=2H2O+Br2+SO2↑与Br2+SO2+2H2O=2HBr+H2SO4
③2NO2=N2O4与N2O4=2NO2
④2SO2+O2  2SO3与2SO3
2SO3与2SO3  2SO2+O2
2SO2+O2
A . ①②
B . ②③
C . ③④
D . ②④
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)→2H2(g)+2CO(g)。
-
(1) 该反应的平衡常数K=。在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,则v(CH4)。
-
(2) 根据如图可得出n(CO2)消耗n(CH4)消耗(填“>”、“<”和“=”,原因是。

下列反应不属于可逆反应的是( )
A .  与
与 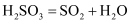 B .
B .  与
与  C .
C . 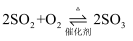 与
与 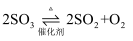 D .
D .  与
与 
 与
与 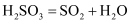 B .
B .  与
与  C .
C . 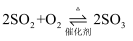 与
与 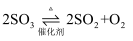 D .
D .  与
与 
一定条件下的恒压绝热容器中发生反应:  .下列有关说法正确的是( )
.下列有关说法正确的是( )
 .下列有关说法正确的是( )
.下列有关说法正确的是( )
A . 达到化学平衡状态时,  B . 容器内的压强不再变化说明反应达到化学平衡状态
C . 升高反应温度,正逆反应速率均增大
D . 加入
B . 容器内的压强不再变化说明反应达到化学平衡状态
C . 升高反应温度,正逆反应速率均增大
D . 加入  和
和  ,充分反应后放出热量
,充分反应后放出热量 
 B . 容器内的压强不再变化说明反应达到化学平衡状态
C . 升高反应温度,正逆反应速率均增大
D . 加入
B . 容器内的压强不再变化说明反应达到化学平衡状态
C . 升高反应温度,正逆反应速率均增大
D . 加入  和
和  ,充分反应后放出热量
,充分反应后放出热量 
环戊二烯( )是重要的有机化工原料,其容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度(初始浓度为1.5mol•L-1)与反应时间的关系如图所示,下列说法正确的是( )
)是重要的有机化工原料,其容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度(初始浓度为1.5mol•L-1)与反应时间的关系如图所示,下列说法正确的是( )
 )是重要的有机化工原料,其容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度(初始浓度为1.5mol•L-1)与反应时间的关系如图所示,下列说法正确的是( )
)是重要的有机化工原料,其容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度(初始浓度为1.5mol•L-1)与反应时间的关系如图所示,下列说法正确的是( )
A . a点的反应速率大于c点的反应速率
B . a点的逆反应速率小于b点的逆反应速率
C . b点时二聚体的浓度为0.9mol•L-1
D . 达到平衡后,升高温度,体系中环戊二烯的百分含量将增加
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 1molP4含共价键数为4NA
B . 4.48LNO和3.2gO2混合,所得气体的分子数目等于0.2NA个
C . 1mol/LNaCl溶液中含有的离子总数为2NA
D . 反应2N2O5(g)  4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1中,吸收54.9kJ热量时转移的电子数为2NA
4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1中,吸收54.9kJ热量时转移的电子数为2NA
 4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1中,吸收54.9kJ热量时转移的电子数为2NA
4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1中,吸收54.9kJ热量时转移的电子数为2NA
-
(1) I.某学生为了探究锌与盐酸反应过程中速率的变化,在100mL稀盐酸中加入足量的锌,用排水集气法收集反应放出的氢气,实验记录如下:
时间/min
1
2
3
4
5
氢气体积/mL
50
120
232
290
310
(填“0~1”“1~2”“2~3”“3~4”或“4~5”)min时间段反应速率最大,原因是。
-
(2) (填“0~1”“1~2”“2~3”“3~4”或“4~5”)min时间段反应速率最小,原因是。
-
(3) 如果要减缓反应速率而又不减少产生氢气的量,下列措施你认为可行的是____。A . 加入KCl溶液 B . 通入HCl气体 C . 加入NaOH固体 D . 加入
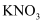 溶液
溶液
-
(4) II.温度一定,在一个2L的恒容密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

该反应的化学方程式为。从开始到平衡时C的反应速率为,A的转化率为。
-
(5) 下列叙述能说明该反应已达到化学平衡状态的是____(填序号)。A . A与C的浓度相等 B . 相同时间内消耗3nmolA,同时生成3nmolA C . 相同时间内消耗3nmolA,同时消耗nmolB D . 混合气体的总质量不随时间的变化而变化 E . B的体积分数不再发生变化 F . 混合气体的密度不再发生变化 G . 混合气体的压强不再发生变化
采用CO2作为碳源,通过催化加氢的方式,不仅可以减少温室气体,还可以转化为高附加值的产品,具有重要的战略意义。CO2催化加氢制烯烃(CnH2n)转化路径涉及的主要反应如图:

请回答下列问题:
-
(1) 2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=kJ·mol-1。
-
(2) 有利于提高体系CO2平衡转化率的措施有____(填标号)。A . 减小n(CO2):n(H2)投料比 B . 减小体系压强 C . 使用高效催化剂 D . 及时分离H2O(g)
-
(3) n(CO2):n(H2)投料比为1∶3、压力为1MPa时,无烷烃产物的平衡体系中CO2转化率和产物选择性随反应温度变化曲线如图。

①有利于短链烯烃(n≤4)生成的温度范围为(填标号)。
A.373~573K B.573~773K C.773~973K D.973~1173K
②已知反应1的v(正)=k正·p(CO2)·p(H2),v(逆)=k逆·p(CO)·p(H2O),计算1083K时,
 =[p(CO2)等代表分压)]。
=[p(CO2)等代表分压)]。③工业上用分子筛作催化剂,可大大提高C2H4的选择性,已知乙烯的截面直径比分子筛的孔径略小,请解释分子筛能提高C2H4的选择性的原因。
④在碱性环境中电催化还原CO2制乙烯,产生乙烯的电极为极(填“阴”或“阳”),该电极的电极反应式为。
-
(4) 在催化剂作用下CO2加氢可制得甲醇,该反应历程如图所示(吸附在催化剂表面的物质用*标注,如*CO2表示CO2吸附在催化剂表面;图中*H己省略)。

上述过程中得到相对较多的副产物为,合成甲醇决速步的化学反应方程式为。
最近更新



