化学反应的可逆性 知识点题库
可选试剂:①0.1mol•L﹣1KI溶液;②0.1mol•L﹣1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4 .
实验步骤:
①取5mL 0.1mol•L﹣1 KI溶液,再滴加5~6滴0.1mol•L﹣1FeCl3溶液。
②充分反应后,将溶液分成三份。
③取其中一份,滴加试剂CCl4 , 用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂 ,现象 ,说明 。
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
①定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是 。
 2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )
2NH3(g).已知反应过程中某一时刻N2、H2、NH3浓度为0.1mol/L、0.3mol/L、0.2mol/L.当反应达到平衡时可能存在的数据是( )
I.取5mL 0.1mol/L的KI溶液,滴加5﹣6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4 , 盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
-
(1) 探究活动I中发生反应的离子方程式为.
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置..
-
(2) 探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4﹣反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
实验操作
现象和结论
步骤一:
若产生暗蓝色沉淀,则.
步骤二:
若乙醚层呈红色,则.
②写出实验操作“步骤一”中的反应离子方程式:.
-
(3) 根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为 mol/L.

下列叙述错误的是( )
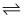 2HI(g)
D . 图①②中当c(HI)=3.16 mol·L-1时,反应达到平衡状态
2HI(g)
D . 图①②中当c(HI)=3.16 mol·L-1时,反应达到平衡状态
 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是( )
 3Z(g) △H=-akJ·mol-1(a>0),下列说法错误的是( )
3Z(g) △H=-akJ·mol-1(a>0),下列说法错误的是( )
 2 Z(g) △H=-akJ/mol,10min后测得Y的物质的量为1.4mol。下列说法不正确的是( )
2 Z(g) △H=-akJ/mol,10min后测得Y的物质的量为1.4mol。下列说法不正确的是( )
 2HI(g)的反应类型判断错误的是( )
2HI(g)的反应类型判断错误的是( )
 2NH3。在10 s内N2的浓度由5 mol/L降至4 mol/L,下列说法正确的是( )
2NH3。在10 s内N2的浓度由5 mol/L降至4 mol/L,下列说法正确的是( )
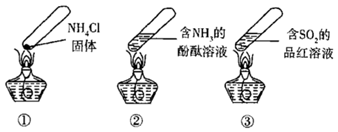
 固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现
固体
B . 加热时,②中溶液变红,冷却后又变为无色
C . 加热时,③中溶液红色褪去,冷却后溶液变红,体现  的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
的漂白性
D . 三个“封管实验”中所发生的化学反应都是可逆反应
| 选项 | c(H2)/mol/L | c(CO)/mol/L | c(CH3OH)/mol/L |
| A | 1.00 | 0.10 | 1.00 |
| B | 0.10 | 2.00 | 0.05 |
| C | 0.02 | 5.00 | 0.30 |
| D | 0.15 | 0.10 | 0.60 |
 2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟(
2SO3(g) △H=-198kJ/mol,反应过程可用如图模拟( 



