影响盐类水解程度的主要因素 知识点
影响盐类水解程度的主要因素:y由水解生成弱电解质的性质决定,水解后的弱酸或弱碱的酸碱性越弱,则该盐电离出的弱酸根离子或者弱碱阳离子的水解程度越大。
影响盐类水解程度的主要因素 知识点题库
NH3及其盐都是重要的化工原料.
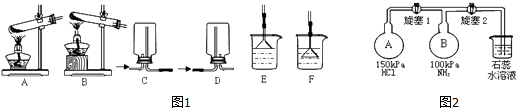
-
(1) 用NH4Cl和Ca(OH)2制备NH3的化学方程式为;该反应发生、气体收集和尾气处理装置如图1依次为;
-
(2) 按如图2装置进行NH3性质实验.先打开旋塞1,B瓶中的现象是,稳定后,关闭旋塞1.再打开旋塞2,B瓶中的现象是;
-
(3) 写出NH4Cl溶液水解的离子方程式;
设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响.
限选试剂与仪器:固体NH4Cl、蒸馏水、250mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、pH计、温度计、恒温水浴槽(可调控温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响;
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中“V(溶液)”表示所配制溶液的体积).
物理量
实验序号
V(溶液)/mL
NH4Cl质量/g
温度/℃
…
1
250
X
…
2
250
…
③按实验序号1所拟数据进行实验,若读取的待测物理量的数值为X,则NH4Cl水解反应的平衡转化率为(只列出算式,忽略水自身电离的影响).
在恒温条件下,在醋酸钠稀溶液中分别加入少量下列物质中①固体NaOH②固体KOH③固体NaHSO4④固体醋酸钠⑤冰醋酸,使  比值一定增大的是( )
比值一定增大的是( )
 比值一定增大的是( )
比值一定增大的是( )
A . ①②
B . ②⑤
C . ①⑤
D . ②④⑤
5.下列关于电解质溶液的叙述不正确的是( )
A . pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
B . pH 相同的①CH3COONa、②NaHCO3、③NaClO 三种溶液的c(Na+):①>②>③
C . 向BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
D . 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
下列关于电解质溶液的叙述正确的是( )
A . 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B . 在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可大量共存
C . 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D . 向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 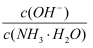 增大
增大
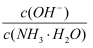 增大
增大
下列有关电解质溶液的说法正确的是( )
A . Na2SO3溶液加水稀释后,pH和KW均减小
B . 0.1mol•L﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C . 浓度分别为0.2mol•L﹣1和0.1mol•L﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D . 室温下,pH=12的氨水与pH=2的H2SO4溶液等体积混合后,溶液呈酸性
室温下,0.1mol·L-1下列溶液的pH最大的是( )
A . Na2SO4
B . NaHCO3
C . NH4Cl
D . Na2CO3
下列实验现象与结论不一致的是( )
选项 | 实验现象 | 实验操作 | 结论 |
A | 等体积等浓度的HA 和HB两种酸分别与足量的锌反应,用排水法收集气体 | HA放出氢气的反应速率更快 | 酸性:HB<HA |
B | 以铜、铁、浓硝酸构成原电池 | 铁表面有红棕色气泡产生 | 铜作原电池的负极 |
C | 向25mL冷水和沸水中分别滴入5滴FeCl3 饱和溶液 | 前者为黄色,后者为红褐色 | 升高温度,Fe3+ 的水解程度增大 |
D | 将固体CaSO4加入Na2CO3 饱和溶液中 | 一段时间后,检验固体主要成分为CaCO3 | Ksp(CaSO4)3>Ksp(CaCO3) |
A . A
B . B
C . C
D . D
下列说法正确的是( )
A . 25 ℃时,向水中加入少量固体NaHSO4 , c(H+)增大,Kw不变
B . 向0.1 mol·L-1CH3COOH溶液中加入少量的CH3COONa晶体,  减小
C . 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小
D . 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
减小
C . 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小
D . 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
 减小
C . 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小
D . 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
减小
C . 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小
D . 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小
 的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3 , 溶质的物质的量浓度由大到小的顺序为( )
的物质的量浓度相等的下列溶液:①(NH4)2SO4 ② (NH4)2Fe(SO4)2 ③(NH4)2CO3 , 溶质的物质的量浓度由大到小的顺序为( )
A . ① > ② > ③
B . ③ > ① > ②
C . ③ > ② > ①
D . ② > ① > ③
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 1mol硝基(-NO2)与46g二氧化氮(NO2)所含的电子数均为23NA
B . 0.1mol/L(NH4)2SO4溶液与0.2 mol/LNH4Cl溶液中的NH4+数目相同
C . 标准状况下,2.24L三氯甲烷中含碳氯共价键的数目为0.3NA
D . 向FeI2溶液中通入适量Cl2 , 当有1 mol Fe2+被氧化时,转移的电子数为NA
常温下,电离常数:Ka(HCOOH)=1.77x10-4、Ka(CH3COOH)=1.75 x10-5有甲、乙、丙三种溶液:
| 甲 | 1000 mL 0.1 mol/L HCOONa溶液 |
| 乙 | 1000 mL 0.1 mol/L CH3COONa溶液 |
| 丙 | 1000 mL含HCOONa、CH3COONa各0.05 mol的溶液 |
下列叙述错误的是( )
A . 溶液中c(Na+):甲=乙=丙
B . 溶液中阴、阳离子和酸分子总数:甲<丙<乙
C . 溶液pH:甲<丙<乙
D . 溶液中阴、阳离子总数:甲<丙<乙
对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A . c(H+) +c(HSO3-) +2c(H2SO3) =c(OH-)
B . c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C . c(Na+)+c(H+)=2c(SO32-)+2c(HSO3-)+c(OH-)
D . 升高温度,溶液pH降低
对于0.1mol•L-1 Na2CO3溶液,下列说法正确的是( )
A . 升高温度,溶液的pH降低
B . c(Na+)=2c(CO32―)+ c(HCO3―)+ c(H2CO3)
C . c(Na+)+c(H+)=2 c(CO32―)+ 2c(HCO3―)+ c(OH―)
D . 加入少量NaOH固体,c(CO32―)与c(Na+)均增大
室温下,有两种溶液:①0.01mol•L﹣1 NH3•H2O 溶液、②0.01mol•L﹣1 NH4Cl 溶液,下列操作可以使两种溶液中 c(NH4+)都增大的是( )
A . 通入少量 HCl 气体
B . 加入少量 NaOH 固体
C . 加入少量 H2O
D . 适当升高温度
在配制Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
A . NaOH
B . H2SO4
C . KCl
D . CH3COOH
在一定条件下,  溶液中存在水解平衡:
溶液中存在水解平衡: 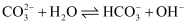 。下列说法正确的是( )
。下列说法正确的是( )
 溶液中存在水解平衡:
溶液中存在水解平衡: 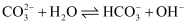 。下列说法正确的是( )
。下列说法正确的是( )
A . 加入  固体,平衡向正反应方向移动
B . 稀释溶液,
固体,平衡向正反应方向移动
B . 稀释溶液,  的水解程度增大
C . 通入
的水解程度增大
C . 通入  ,溶液
,溶液  增大
D . 升高温度,
增大
D . 升高温度,  不变
不变
 固体,平衡向正反应方向移动
B . 稀释溶液,
固体,平衡向正反应方向移动
B . 稀释溶液,  的水解程度增大
C . 通入
的水解程度增大
C . 通入  ,溶液
,溶液  增大
D . 升高温度,
增大
D . 升高温度,  不变
不变
下列说法正确的是( )
A . 水解反应是吸热反应
B . 升高温度可以抑制盐类的水解
C . 正盐水溶液的pH均为7
D . 酸式盐的pH均小于7
常温下,向0.01 mol∙L-1的一元酸HX溶液中通入氨气,此过程混合溶液中  与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )
与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )
 与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( )
与pH之间关系如图所示(忽略溶液的体积变化)。下列叙述正确的是( ) 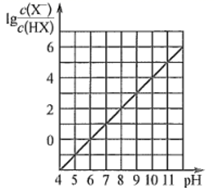
A . pH=7时,溶液中c(  )=
)= 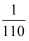 mol∙L-1
B . 常温下,K(HX)≈1×10- 5
C . 当溶液为碱性时,c(X- )<c(HX)
D . 混合溶液中不可能在:c(X-)>c(
mol∙L-1
B . 常温下,K(HX)≈1×10- 5
C . 当溶液为碱性时,c(X- )<c(HX)
D . 混合溶液中不可能在:c(X-)>c(  )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
 )=
)= 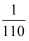 mol∙L-1
B . 常温下,K(HX)≈1×10- 5
C . 当溶液为碱性时,c(X- )<c(HX)
D . 混合溶液中不可能在:c(X-)>c(
mol∙L-1
B . 常温下,K(HX)≈1×10- 5
C . 当溶液为碱性时,c(X- )<c(HX)
D . 混合溶液中不可能在:c(X-)>c(  )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
下列实验中,均产生白色沉淀。
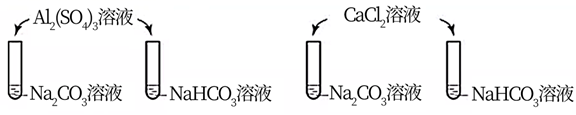 下列分析错误的是( )
下列分析错误的是( )
A . Na2CO3与NaHCO3溶液中所含微粒种类相同
B . CaCl2能促进Na2CO3、NaHCO3水解
C . Al2(SO4)3能促进Na2CO3、NaHCO3水解
D . 4个实验中,溶液滴入后,试管中溶液pH均降低
下列说法正确的是( )
A . 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(NaHCO3)>pH(Na2CO3)
B . 0.1mo/L的Na2CO3溶液中:c(OH-)=c(HCO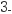 )+c(H+)+c(H2CO3)
C . 常温下,pH=11的NaOH溶液与pH=3CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D . c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液和NH4Cl溶液中:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4HSO4)<c(NH4Cl)
)+c(H+)+c(H2CO3)
C . 常温下,pH=11的NaOH溶液与pH=3CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D . c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液和NH4Cl溶液中:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4HSO4)<c(NH4Cl)
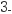 )+c(H+)+c(H2CO3)
C . 常温下,pH=11的NaOH溶液与pH=3CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D . c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液和NH4Cl溶液中:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4HSO4)<c(NH4Cl)
)+c(H+)+c(H2CO3)
C . 常温下,pH=11的NaOH溶液与pH=3CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D . c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2CO3溶液和NH4Cl溶液中:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4HSO4)<c(NH4Cl)
最近更新



