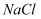影响盐类水解程度的主要因素 知识点题库
25℃时,已知H2CO3⇌H++HCO3﹣K1=4.3×10﹣7;
HCO3﹣⇌H++CO32﹣K2=5.6×10﹣11;
H2O⇌H++OH﹣Kw=1.0×10﹣14
现取10.6g Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )

 ):c(Cl﹣)=1:1的溶液,可在NH4Cl溶液中加入适量的( )
):c(Cl﹣)=1:1的溶液,可在NH4Cl溶液中加入适量的( )
加入的物质 | 结论 | |
A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42﹣) |
B | 0.5mol CaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)•c(OH﹣)不变 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c (Na+)不变 |
①适量的HCl ②适量H2SO4③适量的NaCl④适量的氨水.


(注:SiCl4的沸点是57.6℃,金属氯化物的沸点均高于150℃)
-
(1) 已知1mol石墨完全转化为金刚石需要吸收1.9kJ的能量。请写出石墨转化为金刚石的热化学反应方程式:
-
(2) 向反应器中通入Cl2前,需通一段时间的N2。高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。80℃冷凝的目的是:由活性炭得到气体Ⅱ的化学反应方程式为:
-
(3) 加入过量NaOH溶液得到溶液IV的离子反应方程式为:
-
(4) 用化学反应原理解释得到沉淀V的过程中乙酸乙酯和加热的作用:。1kg初级石墨最多可获得V的质量为kg。
-
(1) 氨的水溶液显弱碱性,其原因为(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度(填“增大”或“减小”);
-
(2) 25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol•L-1;
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]。
-
(3) 25℃,两种酸的电离平衡常数如下表。
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
①HSO3-的电离平衡常数表达式K=;
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为;
③H2SO3溶液和NaHCO3溶液反应的离子方程式为;
-
(4) 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。久存的银器皿表面会变黑,失去银白色的光泽,原因是,已知Ksp(AgCl)=1.8×10-10 , 若向5mL0.018mol•L-1的AgNO3溶液中加入5mL0.020mol•L-1的盐酸,混合后溶液中的Ag+的浓度为mol•L-1 , pH为。
序号 | ① | ② | ③ | ④ |
溶液 |
|
|
|
|
pH | 7.0 | 7.0 | 8.1 | 8.9 |
 B . 离子的总浓度:①>③
C . ②中:
B . 离子的总浓度:①>③
C . ②中:  D . ②和④中
D . ②和④中  相等
相等

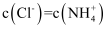 B . a→b过程中,
B . a→b过程中,  不断增大
C . c→d溶液导电性增强的主要原因是
不断增大
C . c→d溶液导电性增强的主要原因是  和
和  增大
D . 根据溶液pH和导电能力的变化可判断:
增大
D . 根据溶液pH和导电能力的变化可判断: 
①明矾和AlCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加入少量盐酸
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4Cl和ZnCl2溶液可作金属焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧长期使用硫铵,土壤酸性增强,草木灰与铵态氮肥不能混合施用
|
试剂 |
pH |
||
|
初始 |
通入0.01mol HCl气体 |
加入0.01mol NaOH固体 |
|
|
i. 1L H2O |
7 |
a |
12 |
|
ii. 0.10 mol CH3COOH+0.10mol CH3COONa配制成1L的溶液 |
4.76 |
4.67 |
4.85 |
-
(1) a=(忽略通入HCl气体前后体系的体积变化)。
-
(2) 结合化学用语解释ii显酸性的原因:。
-
(3) 试剂ii中微利浓度关系正确的有(填序号)。
a.c(CH3COOH)>c(Na+)>c(CH3COO-)
b.2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c.c(CH3COOH)+c(CH3COO-)=0.2mol/L
-
(4) 由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列具有缓冲作用的溶液是(填序号)。
a.HCl---NaCl b.Na2CO3---NaHCO3
c.NH3﹒H2O---NH4Cl d.KOH---KCl
 盐酸滴入10.00mL 0.010
盐酸滴入10.00mL 0.010  氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:
氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:  ,下列说法正确的是( )
,下列说法正确的是( ) 
 B . M点比N点水的电离程度大
C . Q点消耗盐酸的体积等于氨水的体积
D . Q点所示溶液中
B . M点比N点水的电离程度大
C . Q点消耗盐酸的体积等于氨水的体积
D . Q点所示溶液中 
 增大
增大