影响盐类水解程度的主要因素 知识点题库
 增大的是( )
增大的是( )
对于该溶液表述正确的是( )
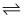 H2CO3+OH- , HCO3-
H2CO3+OH- , HCO3- 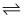 H++CO32-
H++CO32-
 的值减小
D . 对于反应2SO2+O2
的值减小
D . 对于反应2SO2+O2  2SO3 , 使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3 , 使用催化剂能加快反应速率和提高SO2的平衡转化率
-
(1) I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:,你预测的理论依据是(用离子方程式表示):。
-
(2) II.实验探究
配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:。

②测溶液的pH得知溶液呈酸性,其原因是: (用离子方程式表示)。
-
(3) SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:。
-
(4) 为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:。
-
(5) III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:。
 HCO3-+OH-。下列说法错误的是( )
HCO3-+OH-。下列说法错误的是( )
 增大
B . 加入NaOH固体,
增大
B . 加入NaOH固体,  减小
C . 升高温度,平衡常数增大
D . 通入HCl,溶液pH减小
减小
C . 升高温度,平衡常数增大
D . 通入HCl,溶液pH减小
| 选项 | 结论 | 操作 |
| A | CO32-水解是吸热反应 | 在0.1 mol/LNa2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 |
| B | Ksp(BaSO4)>Ksp(BaCO3) | 常温下,用饱和Na2CO3溶液可将BaSO4全部转化为BaCO3 |
| C | 酸性A比B强 | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 |
| D | 金属性:M>N | 由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
HSO3-+H2O  H2SO3+OH- ①
H2SO3+OH- ①
HSO3-  H++SO32- ②
H++SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
 、
、  的值均增大
的值均增大
-
(1) 若浓度均为0.1 mol/L、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则mn(填“>”、“<”或“=”)。
-
(2) 已知水存在如下平衡:
 ,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是________
A . 向水中加入NaHSO4固体 B . 向水中加NaHCO3固体 C . 加热至100℃ [其中c(H+)=1×10-6 mol/L] D . 向水中加入NH4Cl固体
,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是________
A . 向水中加入NaHSO4固体 B . 向水中加NaHCO3固体 C . 加热至100℃ [其中c(H+)=1×10-6 mol/L] D . 向水中加入NH4Cl固体 -
(3) NH4Cl 溶液显酸性的原因是(用离子方程式表示)。
-
(4) 泡沫灭火器的原理是(用离子方程式表示)。
-
(5) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH
 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。
| 选项 | 实验目的 | 实验操作 |
| A | 探究化学反应是否可逆 | 向 |
| B | 比较 | 向 |
| C | 比较 | 将硫酸酸化过的 |
| D | 探究浓度对盐类水解平衡的影响 | 向滴有酚酞的碳酸钠溶液中滴加氯化钡溶液,观察现象 |
-
(1) I.联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
在25℃时,1.00gN2H4(l)与足量N2O4(1)完全反应生成N2(g)和H2O(1),放出19.14kJ的热量。写出该反应的热化学方程式。
-
(2) II.NO2是氮的常见氧化物,能自发发生如下反应:2NO2(g)⇌N2O4(g)
 =-57.20kJ/mol
=-57.20kJ/mol写出该反应的平衡常数表达式K=。已知:在一定温度下的密闭容器中,该反应已达到平衡。保持其他条件不变,下列措施能提高NO2转化率的是。
a.减小NO2的浓度 b.降低温度 c.增大压强 d.升高温度
-
(3) III.Na2CO3俗称纯碱,是生活中的常用物质。某化学兴趣小组的同学对Na2CO3溶液显碱性的原因进行了探究,设计了如下实验方案进行操作并记录实验现象。
实验操作
实验现象
取少量Na2CO3固体,加入无水酒精,充分振荡、静置
溶液为无色
取上层清液于试管中,滴加酚酞试剂
溶液为无色
在试管中继续加入少量水
溶液变为红色
向该红色溶液中滴加足量BaCl2溶液(中性)
红色褪去
①该实验表明,Na2CO3溶液显碱性的原因是(请结合化学用语,简要说明)。
②从形成盐的酸和碱的强弱角度看,Na2CO3属于盐。
③为了使Na2CO3溶液中
 的比值变小,可适量加入(或通入)的物质是。
的比值变小,可适量加入(或通入)的物质是。a.CO2气体 b.KOH固体 c.HCl气体 d.Na2CO3固体
 时,苯酚
时,苯酚 的
的 , 下列说法正确的是( )
, 下列说法正确的是( )
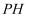 的
的 和
和 溶液中,
溶液中, B . 将浓度均为
B . 将浓度均为 的
的 和
和 溶液加热,两种溶液的
溶液加热,两种溶液的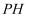 均变大
C .
均变大
C .  时,
时, 溶液与
溶液与 溶液混合,测得
溶液混合,测得 , 则此时溶液中
, 则此时溶液中 D .
D .  时,
时, 的
的 溶液中加少量
溶液中加少量 固体,水的电离程度变小
固体,水的电离程度变小

已知:
金属离子 | Fe3+ | Fe2+ |
开始沉淀时(c=0.01 mol·L-1)的pH | 2.2 | 7.5 |
回答下列问题:
-
(1) 碱浸液中含有的金属元素是。
-
(2) 酸浸时需加热的目的是,酸浸产生TiO2+的离子方程式为。
-
(3) 加NaOH溶液调至a=时,溶液中的杂质离子沉淀完全。
-
(4) 实验时当加入V Lc mol/L H2O2溶液恰好能将酸浸后溶液中的还原性离子全部氧化,则akg钛矿石理论是可制得钛kg(过程中铁、钛无损失),“氧化”中可替代H2O2的物质是。
-
(5) 制取TiO2·xH2O需加入大量水并加热,其目的是 (结合方程式说明)。
-
(6) 为将碱浸液中所含金属化合物转化为金属氧化物,下列试剂必须用到的是____(按试剂使用先后顺序选填试剂标号)。A . 氨水 B . 氢氧化钠 C . 硫酸 D . 醋酸
 溶液中滴加
溶液中滴加  滴
滴  的
的  溶液,充分反应后,滴入
溶液,充分反应后,滴入 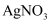 溶液,生成黄色沉淀
溶液,生成黄色沉淀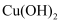 、
、  的
的  的相对大小
的相对大小 溶液中加入
溶液中加入  溶液,再滴加
溶液,再滴加  滴
滴 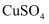 溶液,观察现象
溶液,观察现象 和
和  的氧化性强弱
的氧化性强弱 溶液中,溶液变黄
溶液中,溶液变黄


