电极反应和电池反应方程式 知识点题库
-
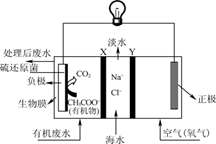
(1) 铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为.
-
(2) 在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示.

①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是.
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是.
-
(3) 纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为.
②纳米铁粉与水中NO3﹣反应的离子方程式为4Fe+NO3﹣+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是.
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是.


-
(1) MgH2是一种离子化合物,其电子式为.
-
(2) Mg2Cu在加压条件下储氢时生成MgH2和MgCu2 , 该反应的化学方程式为.
-
(3) 已知MgH2的有关热化学方程式如下:
MgH2(s)⇌Mg(s)+H2(g)△H1=+74.4 KJ•mol﹣1;
H2(g)+
 O2(g)═H2O(g)△H2=﹣241.8 KJ•mol﹣1;
O2(g)═H2O(g)△H2=﹣241.8 KJ•mol﹣1;Mg(s)+
 O2(g)═MgO(s)△H3=﹣141.6 KJ•mol﹣1 .
O2(g)═MgO(s)△H3=﹣141.6 KJ•mol﹣1 . ①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为.
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为.

-
(4) 炉膛内脱除SO2与NO的反应为2MgO(s)+2SO2 (g)+2NO(g)⇌2MgSO4(s)+N2(g)△H=a KJ•mol﹣1 , 其平衡常数与温度的关系如图乙所示.
①上述反应的平衡常数表达式为K=.
②a(填“>”或“<”)0.
-
(5) 全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2═Mg+2LiH.放电时,X极的电极反应式为.充电时,Y极的电极反应式为.
 B . 碱性燃料电池
B . 碱性燃料电池  C . 质子换膜燃料电池
C . 质子换膜燃料电池  D . 熔融盐燃料电池
D . 熔融盐燃料电池 

(已知甲烷的标准燃烧热ΔH=-890 kJ·mol-1) 。
-
(1) 科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式:;
②该总反应的热化学方程式为:,
-
(2) 利用CO2与H2反应可制备CH4。
已知氢气的标准燃烧热ΔH=-286 kJ·mol-1 ;H2O(g) = H2O (l),ΔH=-44kJ·mol-1;
则二氧化碳与氢气反应生成甲烷和水蒸气的热化学方程式为;
该反应能自发的条件是(填高温或低温)。


 ,且x+y+z=1,充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6 , 其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是( )
,且x+y+z=1,充电时电池总反应为LiNixCoyMnzO2+6C(石墨)=Li1-aNixCoyMnzO2+LiaC6 , 其电池工作原理如图所示,两极之间有一个允许特定的离子X通过的隔膜。下列说法正确的是( ) 


已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
回答下列问题:
-
(1) 浸出渣主要成分为、 (填化学式)。
-
(2) "除铜"时,Fe3+与H2S反应的离子方程式为。
-
(3) "氧化"的目的是将溶液中Fe2+氧化为Fe3+ , 温度需控制在40~50℃之间,该步骤温度不能太高的原因是。
-
(4) "调pH"时,pH的控制范围为。
-
(5) "除钙"后,若溶液中F-浓度为3×10-3mol·L-1 , 则
 =。[已知常温下,
=。[已知常温下,  ]
]
-
(6) 在碱性条件下,电解产生2NiOOH·H2O的原理分两步,其中第一步是Cl-在阳极被氧化为ClO- , 则该步电极反应式为。



已知:在pH为4~6时Fe3+水解生成Fe(OH)3•2nFe3+•3(n-x)SO  胶体,具有吸附性。
胶体,具有吸附性。
-
(1) 从“氨浸”可知,Cu2+、 Fe2+、Co2+三者中易于形成氨合物的离子是 ;含Cu(NH3)
 的溶液“电解”阴极反应式为。
的溶液“电解”阴极反应式为。
-
(2) “酸浸”中硫化钴(CoS) 、Na2SO3与盐酸共同反应的离子方程式为。
-
(3) “除铁”加入了试剂X,使Fe2+转化为Fe3+ , 则试剂X最好选用___________ ( 填字母编号)。A . KMnO4溶液 B . H2O2溶液 C . HNO3 D . SO2
-
(4) “ 萃取”是利用某磷酸酯P50 (用RH表示)萃取钴,其反应的离子方程式为。
-
(5) 整个流程中可以循环利用的物质有。
-
(6) “除铁”中,溶液pH对钴回收影响密切,如下图所示该步应控制pH范围为,pH较大时钴回收率骤降的原因是。(已知Co2+沉淀的pH为6.7~8.7)。


 D . 生成0.1molCH4时阳极室中理论上生成CO2的体积是4.48L(STP)
D . 生成0.1molCH4时阳极室中理论上生成CO2的体积是4.48L(STP)


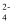 B . 若膜A和A'、B和B'分别为阴、阳离子交换膜,则放电时膜A、B工作
C . 充电时Pd电极的反应式为:
B . 若膜A和A'、B和B'分别为阴、阳离子交换膜,则放电时膜A、B工作
C . 充电时Pd电极的反应式为: D . 若放电时外电路通过1mol电子,则理论上通过双极膜向两极迁移的离子数为NA
D . 若放电时外电路通过1mol电子,则理论上通过双极膜向两极迁移的离子数为NA
 CO2 △H已知反应中化学键数据如下表:
CO2 △H已知反应中化学键数据如下表:化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | 436 | 351 | 745 | 463 | 413 |
回答下列问题:
-
(1) △H(填“>”“<”或“=”)0。
-
(2) 某温度下,向该容器中充入0.3molCO2、0.9molH2 , 发生上述反应,5min末,反应达到平衡,此时测得H2O(g)的物质的量分数为25%。
①0~5min内,
 平均速率v(
平均速率v( )=
)= 。
。②每生成
 , 转移的电子数为
, 转移的电子数为 。
。③反应前后的总压强之比为。
-
(3) 有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是
 ,
,  可以在其中自由移动。电极a的反应式为:
可以在其中自由移动。电极a的反应式为:



