常用仪器及其使用 知识点题库
有如图所示A~H七种仪器:

-
(1) 写出仪器名称:B ,E
-
(2) 欲分离出某乙醇与水的混合液,除铁架台(带铁圈、铁夹)、石棉网、接液管、锥形瓶与酒精灯外,还需上述仪器中的A和 (填仪器编号).
-
(3) 下列关于仪器D的使用方法中,错误的是
A.使用前应检验是否漏液
B.使用时用蒸馏水洗净后,再用待配液润洗
C.能用作物质反应或溶解的容器.
B .
B . 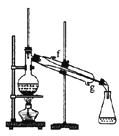
C .
C . 
D .
D . 
a.量筒b.容量瓶c.托盘天平
①其中标出使用温度的仪器是 (填编号)
②能够用来量取液体体积的是 (填编号)
③用托盘天平秤取 10.4g 氯化钠,若将砝码和氯化钠的位置放颠倒了,所秤取的氯化钠的质量实际 是 g
(2)指出使用下列仪器(已经洗涤干净)或用品时的第一步操作:石蕊试纸(检验气体) ,容量瓶 集气瓶(收集氨气) ,托盘天平 .
(15分)凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知:NH3+H3BO3=NH3•H3BO3;NH3•H3BO3+HCl=NH4Cl+H3BO3 .
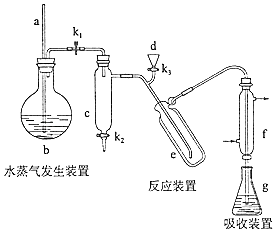
回答下列问题:
-
(1) a的作用是.
-
(2) b中放入少量碎瓷片的目的是.f的名称是.
-
(3) 清洗仪器:g中加蒸馏水:打开K1 , 关闭K2、K3 , 加热b,蒸气充满管路:停止加热,关闭K1 , g中蒸馏水倒吸进入c,原因是;打开K2放掉水,重复操作2~3次.
-
(4) 仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭K1 , d中保留少量水,打开K1 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是.
②e中主要反应的离子方程式为,e采用中空双层玻璃瓶的作用是.
-
(5) 取某甘氨酸(C2H3NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol•L﹣1的盐酸V mL,则样品中氮的质量分数为%,样品的纯度≤%.

①过滤 ②加过量NaOH溶液 ③加适量盐酸
④加过量Na2CO3溶液 ⑤加过量BaCl2溶液

请回答下列问题:
-
(1) 写出①~④的仪器名称:①,②,③,④。
-
(2) 实验室制取并收集氧气时应选择和相连接,制取并收集氢气时应选择和相连接。
-
(3) 进行木炭还原氧化铜并检验生成气体的实验应选择和相连接,检验气体时观察到的实验现象是。
-
(4) 实验室用无水醋酸钠固体和固体碱石灰加热制取甲烷气体。已知甲烷的密度比空气小,不溶于水。则制取甲烷气体可选用的装置为,收集甲烷气体时可选用的装置为。
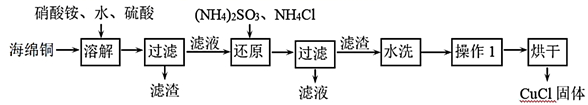
-
(1) 还原过程中主要反应的离子方程式为。
-
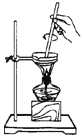
(2) 实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称,有关抽滤,下列说法正确的是

A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
-
(3) 操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂
A.浓盐酸 B.浓氨水 C.无水乙醇 D.水+乙醇
真空干燥的原因是。
-
(4) 随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________A . 增大 B . 不变 C . 减小 D . 不能确定
 的制取装置如图所示。下列编号仪器的名称正确的是( )
的制取装置如图所示。下列编号仪器的名称正确的是( ) 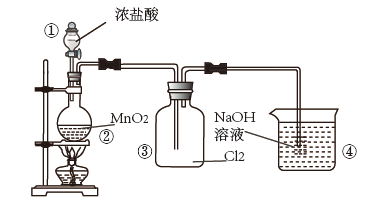
 C . 容量瓶
C . 容量瓶
|
|
|
|
|
|
A.碱式滴定管排气泡 |
B.溶液加热 |
C.试剂存放 |
D.溶液滴加 |
-
(1) I.某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
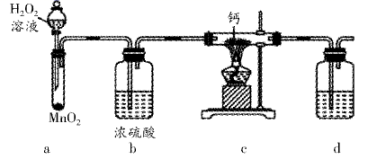
装置d中的试剂是,作用是。
-
(2) 根据上面的实验装置进行实验,步骤如下:
①通入一段时间氧气②熄灭酒精灯③点燃酒精灯④停止通入氧气⑤装入药品及试剂⑥检验装置的气密性
正确的操作顺序是:。
-
(3) II.工业上生产过氧化钙的主要流程如下:
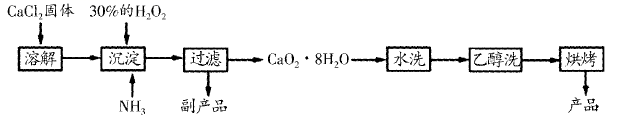
已知:①
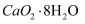 是一种白色晶体,微溶于水,不溶于乙醇,易与酸反应;②沉淀时需控制温度为
是一种白色晶体,微溶于水,不溶于乙醇,易与酸反应;②沉淀时需控制温度为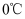 左右。
左右。实验室模拟沉淀反应的所用装置如图:
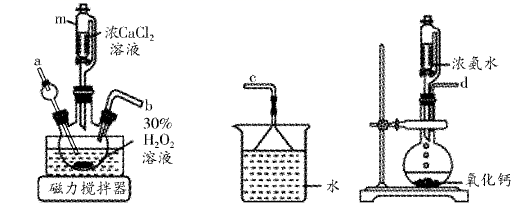
装置的连接顺序为(填字母)。
-
(4) 沉淀时需控制温度为0℃左右的可能原因是。
-
(5) 沉淀步骤发生反应的离子方程式为。
-
(6) 测定
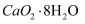 样品纯度的方法是:称取
样品纯度的方法是:称取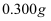 样品于锥形瓶中,加入
样品于锥形瓶中,加入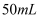 水和
水和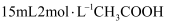 溶液,振荡使样品溶解生成过氧化氢,再加入几滴
溶液,振荡使样品溶解生成过氧化氢,再加入几滴 稀溶液,立即用
稀溶液,立即用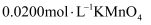 标准溶液滴定到终点,消耗
标准溶液滴定到终点,消耗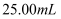 标准溶液。
标准溶液。①样品中
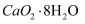 的质量分数为。
的质量分数为。②上述过程中若使用稀硫酸而不使用稀醋酸溶解样品,则测得样品的纯度将(填“偏高”“偏低”或“不变”)。
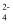 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程:
下列说法错误的是( )