常见化学电源的种类及其工作原理 知识点题库
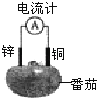
 B . 碱性氢氧化物电池
B . 碱性氢氧化物电池 C . 质子交换膜燃料电池
C . 质子交换膜燃料电池 D . 熔融盐燃料电池
D . 熔融盐燃料电池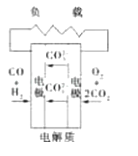
Cd(OH)2+2Ni(OH)2  Cd+2NiO(OH )+2H2O
Cd+2NiO(OH )+2H2O
由此可知,该电池充电时的阳极是( )
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
-
(1) 在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.
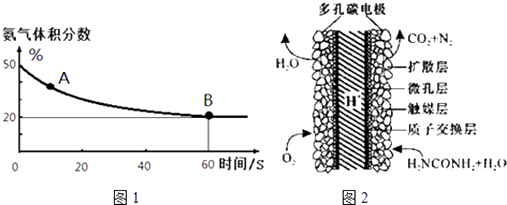
A点的正反应速率v正(CO2) B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为.
-
(2) 氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
温度(℃)
15.0
20.0
25.0
30.0
35.0
平衡气体总浓度 (10﹣3mol/L)
2.4
3.4
4.8
6.8
9.4
①关于上述反应的焓变、熵变说法正确的是.
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=;(填具体数值)NH4+水解平衡常数值为.
-
(3) 化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:.
 2PbSO4+2H2O.下列说法中正确的是( )
2PbSO4+2H2O.下列说法中正确的是( )
Pb+PbO2+4H++2SO42﹣  2PbSO4+2H2O,则下列说法正确的是( )
2PbSO4+2H2O,则下列说法正确的是( )


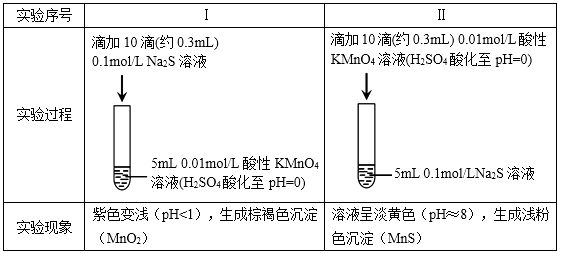
资料:ⅰ.  在强酸性条件下被还原为Mn2+ , 在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+ , 在近中性条件下被还原为MnO2。
ⅱ. 单质硫可溶于硫化钠溶液,溶液呈淡黄色。
-
(1) 根据实验可知,Na2S具有性。
-
(2) 甲同学预测实验I中S2–被氧化成
 。
。 ①根据实验现象,乙同学认为甲的预测不合理,理由是。
②乙同学取实验I中少量溶液进行实验,检测到有
 ,得出S2–被氧化成
,得出S2–被氧化成  的结论,丙同学否定了该结论,理由是。
的结论,丙同学否定了该结论,理由是。③同学们经讨论后,设计了如下实验,证实该条件下
 的确可以将S2–氧化成
的确可以将S2–氧化成  。
。
a.右侧烧杯中的溶液是。
b.连通后电流计指针偏转,一段时间后,(填操作和现象)。
-
(3) 实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(
 )发生反应,该反应的离子方程式是。
)发生反应,该反应的离子方程式是。
-
(4) 实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是。
-
(5) 反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与因素有关。
-
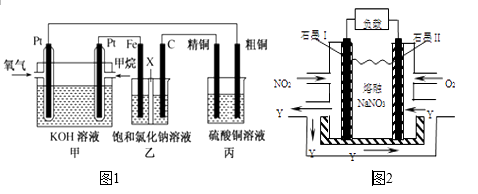
(1) 甲烷燃料电池负极电极反应式是;正极电极反应式是
-
(2) 石墨(C)为极,其电极反应式为;乙中总反应的离子方程式为
-
(3) 若在标准状况下,有2.24 L氧气参加反应,则丙装置中阴极析出铜的质量为g ;
-
(4) 若将甲装置中的甲烷换成甲醇(CH3OH),KOH溶液换成稀硫酸,则负极电极反应式为,消耗等量氧气时,需要甲烷与甲醇的物质的量之比为。
-
(5) NO2、O2和熔融NaNO3可制作燃料电池,其原理见图2,该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为
 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH(熔融)  Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( )
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是( ) 

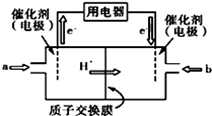

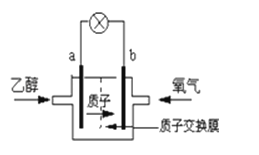
 +2H+
D . 光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移
+2H+
D . 光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移


-
(1) 甲中电流计指针偏移时,盐桥(装有含琼脂的KCl饱和溶液)中离子移动的方向是。
-
(2) 乙中正极反应式为,若将H2换成CH4 , 则负极反应式为。
-
(3) 丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池极相连接。充电时该电极反应式。
-
(4) 若用铅蓄电池作为电源电解硝酸银溶液500毫升,电路中转移0.2 mol电子,则溶液中氢离子浓度(忽略溶液体积变化)。



