常见化学电源的种类及其工作原理 知识点题库
(1)已知甲醇在常温下为液体,其热值为22.7kJ•g﹣1 , 则甲醇的标准燃烧热的热化学方程式为
(2)将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
(3)如图为工业上氯碱工业的电解槽示意图,据图回答:
①图中a、b、c处物质名称分别是:a ;b ;c
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为 .

电池在生产、生活中应用越来越广泛.下列说法错误的是( )
A . 化学电源有一次电池、二次电池和燃料电池等,一次电池只能放电,不能充电
B . 铅蓄电池应用广泛,是一种常见的可充电电池,放电过程中电解质溶液密度逐渐增大
C . 燃料电池具有能量利用率高、可连续使用和污染轻等优点
D . 锂电池是一种高能电池,体积小、重量轻,单位质量电极放出的电能多
银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH﹣﹣2e﹣═ZnO+H2O;Ag2O+H2O+2e﹣═2Ag+2OH﹣;总反应为:Ag2O+Zn═2Ag+ZnO,下列判断正确的是( )
A . 锌为正极,Ag2O为负极
B . 锌为阳极,Ag2O为阴极
C . 原电池工作时,负极区PH减小
D . 原电池工作时,负极区PH增大
某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O  Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
 Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须浸在某碱性溶液中.
A . ①②③
B . ②③
C . ①③④
D . ②③④
关于下列各装置图的叙述不正确的是( )
A .  用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B .
用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B . 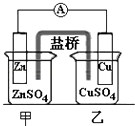 装置的盐桥中KCl的Cl﹣移向甲烧杯
C .
装置的盐桥中KCl的Cl﹣移向甲烧杯
C . 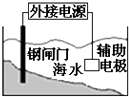 装置中钢闸门应与外接电源的正极相连获得保护
D .
装置中钢闸门应与外接电源的正极相连获得保护
D . 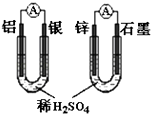 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
 用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B .
用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B .  装置的盐桥中KCl的Cl﹣移向甲烧杯
C .
装置的盐桥中KCl的Cl﹣移向甲烧杯
C .  装置中钢闸门应与外接电源的正极相连获得保护
D .
装置中钢闸门应与外接电源的正极相连获得保护
D .  两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理如图:

①Pt电极上发生的是反应(填“氧化”或“还原”).
②写出NiO电极的电极反应:.
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为2CH3OH+3O2+4OH﹣  2CO32﹣+6H2O,则下列说法中正确的是( )
2CO32﹣+6H2O,则下列说法中正确的是( )
 2CO32﹣+6H2O,则下列说法中正确的是( )
2CO32﹣+6H2O,则下列说法中正确的是( )
A . 充电时有CH3OH生成的电极为阳极
B . 充电时每生成1mol CH3OH转移12mol电子
C . 放电时电解质溶液的pH逐渐增大
D . 放电时负极的电极反应为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
下列说法正确的是( )
A . 用石墨棒做电极电解氯化铜溶液,与负极相连的石墨棒上有气泡产生
B . 氢氧燃料电池工作时氢气在负极被氧化
C . 铅蓄电池充电时,PbSO4仅在负极生成
D . 红热的铁丝与冷水接触,表面形成蓝黑色保护层,这种变化属于原电池反应
普通干电池负极的电极反应式是( )
A . Zn﹣2e﹣=Zn2+
B . Zn2++2e﹣=Zn
C . 4OH﹣﹣4e﹣=O2↑+2H2O
D . 2H++2e﹣=H2↑
新型液态金属Li-Sb电池具有优良的动力传输特性,工作原理如图所示,该电池的两极及电解液被分成3层(熔融Li和Sb可互溶)。下列说法正确的是( )

A . 电池放电时Li为正极
B . 将Li换成Na会提高该电池的比能量
C . 该电池充电时阳极金属的总质量不变
D . 在Sb电极中常掺入Pb,目的是降低该电池工作温度
锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是熔融薄膜状的碘化锂,正极的电极反应式为P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI。下列说法正确的是( )
A . 该电池放电时,锂电极发生还原反应
B . 该电池发生的总反应为2Li+P2VP·nI2=P2VP·(n-1)I2+2LiI
C . P2VP和I2的复合物是绝缘体,不能导电
D . 该电池工作时,碘离子移向正极
铝石墨双离子电池是一种全新低成本、高效电池。原理为:AlLi+Cx(PF6) 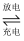 Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
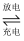 Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
A . 放电时,外电路中电子向铝锂电极移动
B . 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C . 充电时,应将铝石墨电极与电源负极相连
D . 充电时,若电路中通过1 mol电子,阴极质量增加9 g
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列说法错误的是( )

A . 该过程是将太阳能转化为化学能的过程
B . GaN表面发生氧化反应:2H2O-4 e-=O2↑+4H+
C . Cu表面的反应是:CO2+8e-+6H2O =CH4+8OH-
D . H+透过质子交换膜从左向右迁移
装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2+2H2O 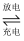 Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是( )
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是( )
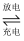 Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是( )
Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,Y附近溶液先变红。下列说法正确的是( ) 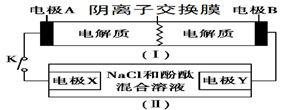
A . 闭合K时,X的电极反应式为:2H++2e-= H2↑
B . 闭合K时,A电极反应式为:NiO2+2e-+2H+= Ni(OH)2
C . 给装置(Ⅰ)充电时,B极参与反应的物质被氧化
D . 给装置(Ⅰ)充电时,OH- 通过阴离子交换膜,移向A电极
PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常广泛。
-
(1) PSCl3(结构式为:
 )中磷的化合价为。
)中磷的化合价为。
-
(2) S2Cl2分子中各原子均满足8电子结构,画出S2Cl2的结构式:。
-
(3) 能说明同周期的相邻元素S的非金属性比Cl弱的事实是_____(填标号)。A . H2SO3的酸性比HClO3的弱 B . 气态H2S的热稳定性比HCl的弱 C . Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓ D . SO2是常见的还原剂,ClO2是常见的氧化剂
-
(4) SOCl2(沸点78.8℃)可用作锂电池的非水电解质及有机合成的氯化剂等。
①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,该反应的化学方程式为。
②Li/SOCl2电池的电池反应为:4Li+2SOCl2→4LiCl↓+S+SO2。电池工作时,下列说法正确的是(填标号)。
A.Li电极的质量不变 B.电能转变为化学能
C.负极发生氧化反应 D.正极上SOCl2被还原
已知空气—锌电池的电极反应如下: 锌片电极:Zn+2OH--2e-=ZnO+H2O,石墨电极:  O2+H2O+2e-=2OH- , 可以判断石墨电极是( )
O2+H2O+2e-=2OH- , 可以判断石墨电极是( )
 O2+H2O+2e-=2OH- , 可以判断石墨电极是( )
O2+H2O+2e-=2OH- , 可以判断石墨电极是( )
A . 负极,发生还原反应
B . 正极,发生氧化反应
C . 负极,发生氧化反应
D . 正极,发生还原反应
电动汽车以锂电池提供动力,锂电池技术已经成为汽车研究的前沿科技某锂电池的电池反应为:xLi+Li3-xNiCoMnO6  Li3NiCoMnO6 , 下列说法正确的是( )
Li3NiCoMnO6 , 下列说法正确的是( )
 Li3NiCoMnO6 , 下列说法正确的是( )
Li3NiCoMnO6 , 下列说法正确的是( )
A . 该电池的充、放电过程互为可逆反应
B . 放电时,电池的负极反应为Li-e-=Li+
C . 放电过程中,Li+向电池的负极移动
D . 该电池可以采用醋酸、乙醇等作为电解质溶液
银锌电池广泛用作各种电子仪器的电源,它的放电过程可以表示为Ag2O+Zn+H2O=2Ag+Zn(OH)2 , 电池放电时,负极发生反应的物质是( )
A . Ag
B . Zn(OH)2
C . Ag2O
D . Zn
下列说法错误的是( )
A . 铅蓄电池属于二次电池
B . CH3CH2OH和CH3COOH具有相同的官能团
C .  与
与 互为同位素
D . 正丁烷与异丁烷互为同分异构体
互为同位素
D . 正丁烷与异丁烷互为同分异构体
 与
与 互为同位素
D . 正丁烷与异丁烷互为同分异构体
互为同位素
D . 正丁烷与异丁烷互为同分异构体
以CO2生产甲醇(CH3OH)是实现“碳中和”的重要途径。其原理是CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
-
(1) 该反应的能量变化如图所示,该反应为(填“放热”或“吸热”)反应。

-
(2) 恒容容器中,对于上述反应,下列措施能加快反应速率的是____。A . 升高温度 B . 充入He C . 加入合适的催化剂 D . 降低压强
-
(3) 在体积为2L的密闭容器中,充入1molCO2和3molH2 , 测得CO2、CH3OH的物质的量随时间变化如图。反应达到平衡状态,此时H2的转化率为。

-
(4) 在相同温度、容积不变的条件下,不能说明该反应已达平衡状态的是____。A . CO2、H2的浓度均不再变化 B . 体系压强不变 C . n(CH3OH)∶n(H2O)=1∶1 D . H2的消耗速率与CH3OH的生成速率之比为3∶1
-
(5) 用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图。

①则电极c是(填“正极”或“负极”),电极d的电极反应式。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。
最近更新



