常见化学电源的种类及其工作原理 知识点
常见化学电源的种类及其工作原理:常见三类,一类是电池,又称干电池,只能放电,负极一般是活泼的金属,容易失去电子,正极是氧化剂容易得电子的物质。如碱性锌锰干电池,南孚电池等。
第二类是二次电池,比如铅蓄电池,即可以放电又可以充电。放电过程中同一类原电池,当放电完后可以充电,充电过程中发生的也是氧化还原反应,将产物复原。
第三类是燃料电池。燃料在负极,氧化剂在正极分别充入,用的时候充进去发生氧化还原反应。
第二类是二次电池,比如铅蓄电池,即可以放电又可以充电。放电过程中同一类原电池,当放电完后可以充电,充电过程中发生的也是氧化还原反应,将产物复原。
第三类是燃料电池。燃料在负极,氧化剂在正极分别充入,用的时候充进去发生氧化还原反应。
常见化学电源的种类及其工作原理 知识点题库
2010年上海世博会,上海将有千辆氢燃料电池车上路,关于氢燃料电池下列说法不正确的是( )
A . 氢燃料电池是一种具有应用前景的绿色电源
B . 氢燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
C . 氢燃料电池能量转换率比氢气直接燃烧高
D . 氢燃料 电池工作时,发出淡蓝色火焰
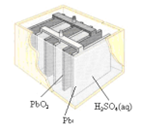
铅蓄电池是典型的可充电电池,它的正负极板是惰性材料,分别吸附着PbO2和Pb,电池总反应式为:Pb+PbO2+4H++2
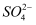
 2PbSO4+2H2O
2PbSO4+2H2O

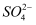
试回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是;电解液中H2SO4的浓度将变 ;当外电路通过1mol电子时,理论上负极板的质量增加 g.
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成 、B电极上生成 ,B极的电极反应式为
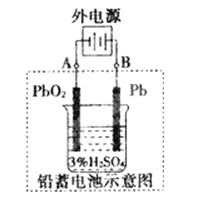
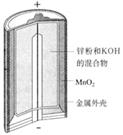
锌锰电池(俗称干电池)在生活中的用量很大.两种锌锰电池的构造如图(a)所示.回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2═Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是 ,电解质的主要成分是 正极发生的主要反应是
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是
(2)图(b)表示回收利用废旧普通锌锰电池工艺(不考虑废旧电池中实际存在的少量其他金属).
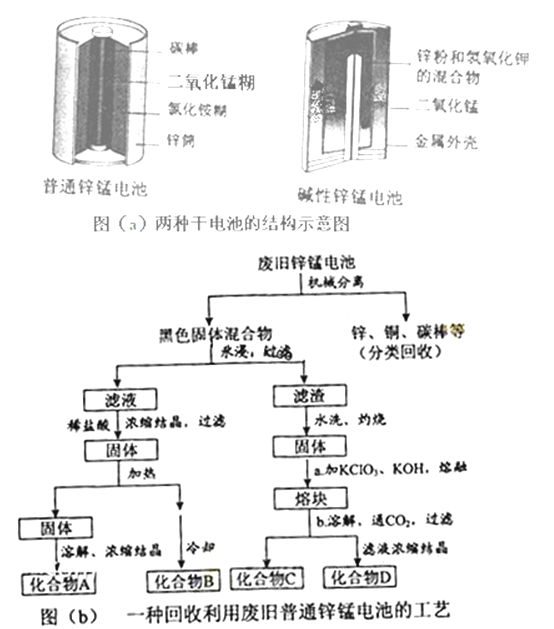
①图(b)中产物的化学式分别为A ,B
②操作a中得到熔块的主要成分是K2MnO4 . 操作b中,绿色的K2MnO4溶液反应生成紫色溶液和一种黑褐色固体,该反应的离子方程式为
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是(填化学式).
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.上述电池工作时,有关说法正确的是( )
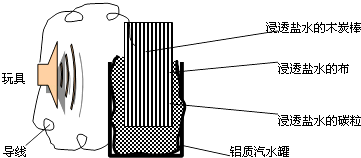
A . 铝罐将逐渐被腐蚀
B . 碳粒和炭棒上发生的反应为:O2+4e﹣=2O2﹣
C . 炭棒应与玩具电机的负极相连
D . 该电池工作一段时间后炭棒和炭粒的质量会减轻
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O  Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
 Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A . 放电时负极附近溶液的碱性不变
B . 充电过程是化学能转化为电能的过程
C . 充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D . 放电时电解质溶液中的OH﹣向正极移动
燃料电池是燃料(如CO、H2、CH4等)跟氧气(或空气)发生反应将化学能转变为电能的装置,若电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是( )
A . 负极反应式:O2+2H2O+4e﹣═4OH﹣
B . 负极反应式:CH4+8OH﹣﹣8e﹣═CO2+6H2O
C . 随着放电的进行,溶液的pH不变
D . 放电时溶液中的阴离子向负极移动
据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A . 正极反应式为:O2+2H2O+4e﹣=4OH﹣
B . 工作一段时间后,电解液中KOH的物质的量不变
C . 该燃料电池的总反应方程式为:2H2+O2=2H2O
D . 该电池反应2.24 L H2(标准状况)时,有0.1 mol电子转移
高铁电池是以高铁酸盐(K2FeO4)和锌为电极材料,具有能量密度大、体积小、重量轻、寿命长、无污染等优点,除比亚迪外目前还没有其他厂家宣称其产品可以大规模实用化.电池的总反应为:3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
 3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列说法正确的是( )
A . 充电时阳极反应式为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B . 0.1molK2FeO4发生反应,转移电子数约为1.806×1024
C . 充电时K2FeO4发生氧化反应
D . 放电时正极反应为:2FeO42﹣+6e﹣+8H2O=2Fe(OH)3+10OH﹣
氢氧燃料电池是一种污染小,效率高的新型化学电源,可应用于航天器上.其总反应的化学方程式为:2H2+O2=2H2O 该电池的负极反应式为可表示为( )
A . 2H2﹣4e﹣=4H+
B . 4H++4e﹣=2H2
C . 2H2O+O2+4e﹣=4OH﹣
D . 4OH﹣﹣4e﹣=2H2O+O2
某固体酸性燃料电池以Ca(HSO4)2固体为电解质传递H+ , 其基本结构见图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
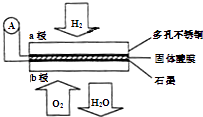
A . 电子通过外电路从b极流向a极
B . 每转移0.1mol电子,消耗1.12L的H2
C . H+由a极通过固体酸电解质传递到b极
D . b极上的电极反应式为:O2+2H2O+4e﹣═4OH﹣
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )

A . 正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B . 放电过程中,Li+向负极移动
C . 每转移0.1 mol电子,理论上生成20.7 g Pb
D . 常温时,在正负极间接上电流表或检流计,指针不偏转
下列说法正确的是( )
A . 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B . SO3与Ba(NO3)2溶液反应可得到BaSO4 , SO2与Ba(NO3)2溶液可得到BaSO3
C . 明矾水解生成Al(OH)胶体,可用作净水剂
D . 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
已知铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 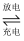 2H2O+2PbSO4;镍铬碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
2H2O+2PbSO4;镍铬碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
 2H2O+2PbSO4;镍铬碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
2H2O+2PbSO4;镍铬碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-负极反应为:Cd+2OH--2e-=Cd(OH)2 , 铅蓄电池使用(充电)一段时间后,其内阻明显增大,电压确几乎不变,此时只有充电才能继续使用。镍铬碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻确几乎不变,此时充电后也能继续使用。回答下列问题:
-
(1) 铅蓄电池在放电时的负极反应为,其在充电时阳极反应为
-
(2) 镍铬碱性充电电池在充电时的总反应的方程式为
-
(3) 上述两种总电池在使用一段时间后,一个内阻明显增大,另一个内阻却几乎不变的主要原因可能是
-
(4) 如果铅蓄电池在放电时贿赂中有2mol电子转移时,消耗H2SO4
铅蓄电池是重要的化学电源之一,其反应为:Pb+PbO2+2H2SO4  PbSO4+2H2O。下列说法中错误的是( )
PbSO4+2H2O。下列说法中错误的是( )
 PbSO4+2H2O。下列说法中错误的是( )
PbSO4+2H2O。下列说法中错误的是( )
A . 充电时阴极为 PbSO4 变为 Pb,发生氧化反应
B . 充电时 Pb 与电源负极相连
C . 放电时正极增加 64 g,转移 2 mol 电子
D . 阳极电极反应为:PbSO4-2e-+2H2O= PbO2+4H++SO42-
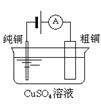
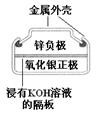
有关下列四个常用电化学装置的叙述中,正确的是( )
| | | | |
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A . 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂
B . 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变
C . 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D . 图IV所示电池工作过程中,Ag2O是氧化剂
如图所示的化学电源在日常生活和高科技领域中都有广泛应用,有关以上化学电源说法不正确是( )
A . 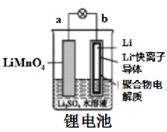 图中:放电时,溶液中Li+从a向b迁移
B .
图中:放电时,溶液中Li+从a向b迁移
B . 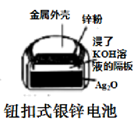 图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C .
图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C . 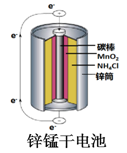 图中:锌筒作负极,发生氧化反应,锌筒会变薄
D .
图中:锌筒作负极,发生氧化反应,锌筒会变薄
D . 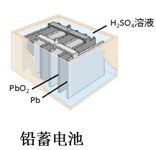 图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
 图中:放电时,溶液中Li+从a向b迁移
B .
图中:放电时,溶液中Li+从a向b迁移
B .  图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C .
图中:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C .  图中:锌筒作负极,发生氧化反应,锌筒会变薄
D .
图中:锌筒作负极,发生氧化反应,锌筒会变薄
D .  图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
图中:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。
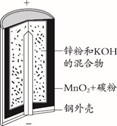
下列关于原电池和干电池的说法错误的是( )
A . 两者正极材料不同
B . MnO2的放电产物可能是KMnO4
C . 两者负极反应式均为Zn失电子
D . 原电池中Zn与稀H2SO4存在自放电现象
2020年3月29日,全球新能源汽车领导者比亚迪宣布正式推出“刀片电池”。“刀片电池”是将传统磷酸铁锂电池电芯加长,使单个电芯形状扁平、窄小,再通过多个“刀片”捆扎形成模组,通过少数几个大模组的组合成电池。“刀片电池”放电时结构如下,正极反应为:Li1-xFePO4+xe-+xLi+=LiFePO4 , 下列说法错误的是( )
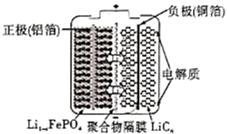
A . “刀片电池”和三元锂电池(镣钻锭酸锂电池)相比几乎没有污染
B . 放电时,负极反应为LiC6-xe-=xLi++Li1-xC6
C . 充电时,锂离子在阴极脱嵌;放电时,锂离子在正极脱嵌
D . 该电池维持电流强度4.825A,工作10分钟,理论上正极增加重量0.21g(已知F=96500C/mol)
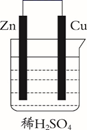
化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A . 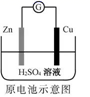 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B .
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B .  正极的电极反应式为Ag2O+2e−+H2O
正极的电极反应式为Ag2O+2e−+H2O  2Ag+2OH−
C .
2Ag+2OH−
C .  锌筒作负极,发生氧化反应,锌筒会变薄
D .
锌筒作负极,发生氧化反应,锌筒会变薄
D . 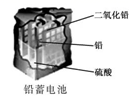 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B .
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B .  正极的电极反应式为Ag2O+2e−+H2O
正极的电极反应式为Ag2O+2e−+H2O  锌筒作负极,发生氧化反应,锌筒会变薄
D .
锌筒作负极,发生氧化反应,锌筒会变薄
D .  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
下列有关实验原理或操作正确的是( )

A . 图甲装置,吸收HCl气体时可以防止倒吸
B . 图乙装置, 移向负极实现化学能转化为电能
C . 图丙装置,从下层放出
移向负极实现化学能转化为电能
C . 图丙装置,从下层放出 实现与水的分离
D . 图丁装置,制备
实现与水的分离
D . 图丁装置,制备
 移向负极实现化学能转化为电能
C . 图丙装置,从下层放出
移向负极实现化学能转化为电能
C . 图丙装置,从下层放出 实现与水的分离
D . 图丁装置,制备
实现与水的分离
D . 图丁装置,制备
最近更新