常见化学电源的种类及其工作原理 知识点题库
高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
下列叙述不正确的是( )
A . 该电池放电时的正极和充电时的阴极均发生还原反应
B . 放电时负极反应为:MH+OH--e- = M+H2O
C . 充电时阳极反应为:NiOOH+H2O+e- = Ni(OH)2+OH-
D . 放电时每转移1mol电子,正极有1molNiOOH被还原
氢氧燃料电池用于航天飞船,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:①2H2+4OH﹣-4e﹣=4H2O,②O2+2H2O+4e﹣=4OH﹣ 当得到1.8L饮用水时,电池内转移的电子数约为( )
A . 1.8mol
B . 3.6mol
C . 100mol
D . 200mol
如图为铅蓄电池的示意图.下列说法正确的是( )

A . 放电时,N为负极,其电极反应式为:PbO2+SO42﹣+4H++2e﹣=PbSO4+2H2O
B . 放电时,c(H2SO4)不变,两极的质量增加
C . 充电时,阳极反应式为:PbSO4+2e﹣=Pb+SO42﹣
D . 充电时,若N连电源正极,则该极生成PbO2
下列叙述中正确的是( )

A . 图①中正极附近溶液pH降低
B . 图②正极反应是2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C . 图①中电子由Fe流向石墨,盐桥中的Cl﹣移向FeSO4溶液
D . Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
氢氧燃料电池是一种新能源.如图为氢氧燃料电池示意图.下列说法不正确的是( )

A . 该装置能将化学能转化为电能
B . A极是正极,B极是负极
C . 电子由A极通过导线流向B极
D . 产物为无污染的水,属于环境友好电池
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
A . 电池工作时,锌失去电子
B . 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq)
C . 电池工作时,电子由正极通过外电路流向负极
D . 外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A . 放电时负极反应为:Zn﹣2e+2OH=Zn(OH)2
B . 充电时阳极反应为:Fe(OH)3﹣3e+5OH﹣=FeO42﹣+4H2O
C . 放电时每转移3mol电子,正极有1molK2FeO4被氧化
D . 放电时正极附近溶液的碱性增强
Li﹣CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域.
-
(1) Li﹣CuO电池中,金属锂做极.
-
(2) 比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣.比较Li、Na、Al分别作为电极时比能量的大小:.
-
(3) 通过如下过程制备CuO
Cu
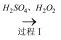 CuSO4溶液
CuSO4溶液  Cu2(OH)2CO3沉淀
Cu2(OH)2CO3沉淀  CuO
CuO①过程Ⅰ,H2O2的作用是.
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是.
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%.

二者比值为1:0.8时,产品中可能含有的杂质是,产生该杂质的原因是.
④过程Ⅲ反应的化学方程式是.
-
(4) Li﹣CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如图2.放电时,正极的电极反应式是.
水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084%CaO。 




-
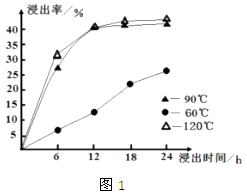
(1) 在一定浓度的
 溶液中,钴的浸出率随时间、温度的变化如图1所示
溶液中,钴的浸出率随时间、温度的变化如图1所示  考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为
考虑生产成本和效率,最佳的浸出时间为小时,最佳的浸出温度为 
-
(2) 请配平下列除铁的化学方程式:
_ _Fe2(SO4)3+H2O +Na2CO3 =Na2Fe6(SO4)4(OH)12↓+Na2SO4 +CO2↑
-
(3) “除钙、镁”的原理反应为:
 ;
;  已知
已知  ,加入过量NaF溶液反应完全后过滤,则滤液中
,加入过量NaF溶液反应完全后过滤,则滤液中  .
.
-
(4) “沉淀”中含杂质离子主要有
 、
、  、和;“操作X”包括和。
、和;“操作X”包括和。
-
(5) 某锂离子电池正极是
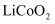 ,含
,含  导电固体为电解质
导电固体为电解质  充电时,
充电时,  还原为Li,并以原子形式嵌入电池负极材料碳
还原为Li,并以原子形式嵌入电池负极材料碳  中
中  如图2所示
如图2所示  电池反应为
电池反应为 
 ,写出该电池放电时的正极反应式 .
,写出该电池放电时的正极反应式 .
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法正确的是( )
A . 电池的电解液为碱性溶液,正极发生氧化反应
B . 电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2
C . 电池充电过程中,阴极附近溶液的pH降低
D . 电池充电时,阳极反应为2Ni(OH)2+2OH-- 2e-= Ni2O3+3H2O
某太阳能电池的工作原理如图所示。下列说法正确的是( )

A . 硅太阳能电池供电原理与该电池相同
B . 光照时, H+由a极区经质子交换膜向b极区迁移
C . 光照时,b极的电极反应式为 VO2+-e-+H2O=VO2++2H+
D . 夜间无光照时,a极的电极反应式为V3++e-=V2+
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是( )

A . 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B . 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C . 电池放电时Na+从b极区移向a极区
D . 电极a采用MnO2 , MnO2既作电极材料又有催化作用
煤的液化可以合成甲醇。下列有关说法正确的是( )
①“气化”:C(s)+2H2O(g)=CO2(g)+2H2(g)ΔH1=+90.1kJ·mol-1
②催化液化I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ·mol-1
③催化液化Ⅱ:CO2(g)+2H2(g)=CH3OH(g)+  O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
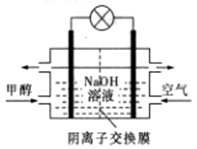
A . 催化液化I的反应在高温下更容易自发进行
B . C(s)+H2O(g)+H2(g)=CH3OH(g)△H=+41.1kJ·mol-1
C . △H2>△H3
D . 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+6OH-=CO2↑+5H2O
下图所示是元素周期表的轮廓图,根据元素①~⑩在周期表中的位置,按题目要求回答问题:

-
(1) 元素①、②能形成 16 电子的分子,该分子的电子式为, 元素①、③能形成 10 电子的分子,请用电子式表示该物质的形成过程;
-
(2) 元素④、⑤、⑥形成的简单氢化物的热稳定性从小到大顺序为(用化学式表示);
-
(3) 将过量的元素⑩单质加入到元素③最高价氧化物水化物的稀溶液中,发生反应的离子反应方程式为;
-
(4) 铅元素在元素周期表中的位置为,铅酸蓄电池是典型的二次电池,在生活中有广泛的应用,其放电时正极的电极反应式为,放电一段时间后,正极质量增加 6.4g,则这段时间,转移电子物质的量为mol。
下列有关电池的说法错误的是( )
A . 手机用的锂离子电池属于二次电池
B . 锌锰干电池中锌电极是负极
C . 甲醇燃料电池可把化学能转化为电能
D . 汽车所用的铅蓄电池可以无限次的反复放电、充电
人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e- =ZnO+H2O,Ag2O+H2O+2e- =2Ag+2OH-。据此判断氧化银是( )
A . 正极,被还原
B . 负极,被氧化
C . 正极,被氧化
D . 负极,被还原
自古以来,化学与人类生产、生活密切相关,下列有关说法错误的是( )
A . 杜康用高粱酿酒的原理,是通过蒸馏法将高粱中的乙醇分离出来
B . 制造新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
C . “深海勇士”号潜水艇使用的锂离子电池是一种二次电池
D . 唐代诗人刘禹锡的《浪淘沙》中“美人首饰侯王印,尽是沙中浪底来”不涉及氧化还原反应
化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )

A . ①中,电子由Cu电极通过电流表流向石墨电极
B . ②中,干电池正极电极反应式为: C . ③中,Cu2+移向待镀铁制品且溶液中Cu2+的浓度降低
D . ④中,为了保护铁电极不受腐蚀,M应接电源的负极
C . ③中,Cu2+移向待镀铁制品且溶液中Cu2+的浓度降低
D . ④中,为了保护铁电极不受腐蚀,M应接电源的负极
 C . ③中,Cu2+移向待镀铁制品且溶液中Cu2+的浓度降低
D . ④中,为了保护铁电极不受腐蚀,M应接电源的负极
C . ③中,Cu2+移向待镀铁制品且溶液中Cu2+的浓度降低
D . ④中,为了保护铁电极不受腐蚀,M应接电源的负极
氮元素的单质及其化合物是化学研究的热点。回答下列问题:
-
(1) 肼(N2H4 , 常温下为液态)是火箭的传统燃料之一,某N2H4-O2原电池的工作原理如图甲。

①a极的电极反应式为。
②该电池工作时,若有2 mol电子流经外电路,则被还原的O2体积为L(标准状况下)。
-
(2) 一定温度时,在体积为2 L的恒容反应器中发生反应:
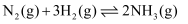 , A、B物质的量随时间的变化曲线如图乙所示。
, A、B物质的量随时间的变化曲线如图乙所示。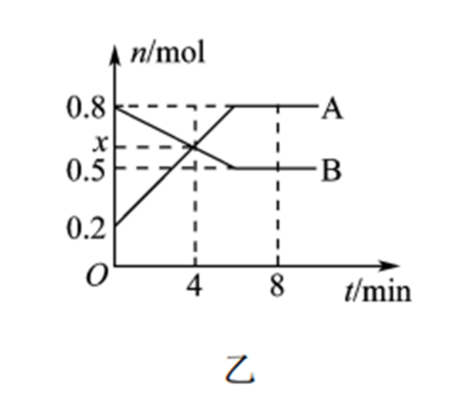
①A为(填化学式)。
②4 min时,v正(填“>”“<”或“=”) v逆。
③
 内该反应的平均反应速率v(H2)=(保留两位有效数字)
内该反应的平均反应速率v(H2)=(保留两位有效数字) 。
。④
 ,反应进行4 min时,N2的转化率为
,反应进行4 min时,N2的转化率为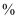 。
。
根据氧化还原反应 , 设计原电池,下列有关说法中正确的是( )
, 设计原电池,下列有关说法中正确的是( )
 , 设计原电池,下列有关说法中正确的是( )
, 设计原电池,下列有关说法中正确的是( )
A . 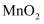 在电池的正极发生氧化反应
B . 电流方向是从锌极流出并经过用电器流向二氧化锰电极
C . Zn极上发生的电极反应为
在电池的正极发生氧化反应
B . 电流方向是从锌极流出并经过用电器流向二氧化锰电极
C . Zn极上发生的电极反应为 D . 电解质溶液可能是稀硫酸
D . 电解质溶液可能是稀硫酸
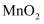 在电池的正极发生氧化反应
B . 电流方向是从锌极流出并经过用电器流向二氧化锰电极
C . Zn极上发生的电极反应为
在电池的正极发生氧化反应
B . 电流方向是从锌极流出并经过用电器流向二氧化锰电极
C . Zn极上发生的电极反应为 D . 电解质溶液可能是稀硫酸
D . 电解质溶液可能是稀硫酸
最近更新



