зү©иҙЁжЈҖйӘҢе®һйӘҢж–№жЎҲзҡ„и®ҫи®Ў зҹҘиҜҶзӮ№йўҳеә“
пјҲ1пјүж··еҗҲзү©еҠ ж°ҙеҫ—еҲ°ж— иүІжә¶ж¶Іпјӣ
пјҲ2пјүеҗ‘дёҠиҝ°жә¶ж¶Ідёӯж»ҙеҠ иҝҮйҮҸBaCl2жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢе°ҶиҜҘжІүж·Җж»ӨеҮәпјҢжӯӨжІүж·ҖеҸҜе®Ңе…Ёжә¶дәҺзЁҖHNO3пјӣ
пјҲ3пјүеҗ‘пјҲ2пјүзҡ„ж»Өж¶ІдёӯеҠ е…ҘAgNO3жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢиҜҘжІүж·ҖдёҚжә¶дәҺзЁҖHNO3 пјҺ жҚ®жӯӨпјҢеҸҜеҲӨж–ӯеҮәж··еҗҲзү©дёӯиӮҜе®ҡдјҡжңүгҖҖ пјҢиӮҜе®ҡжІЎжңүгҖҖ пјҢеҸҜиғҪеҗ«жңүгҖҖ пјҺеҶҷеҮәжӯҘйӘӨпјҲ2пјүдёӯж¶үеҸҠзҡ„зӣёе…іеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ
в‘ еҸ–е°‘йҮҸеӣәдҪ“зІүжң«еҠ еҲ°и¶ійҮҸж°ҙдёӯпјҢеҫ—еҲ°ж— иүІжә¶ж¶Іпјӣ
в‘ЎеҸ–в‘ дёӯжә¶ж¶Іе°‘йҮҸ继з»ӯеҫҖе…¶дёӯеҠ е…Ҙи¶ійҮҸзЁҖзЎ«й…ёпјҢжңүж°”жіЎдә§з”ҹпјӣ
③继з»ӯеҗ‘в‘Ўдёӯзҡ„жә¶ж¶Іж»ҙеҠ BaпјҲNO3пјү2жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјӣ
в‘ЈеҸ–в‘ дёӯжә¶ж¶Іе°‘йҮҸпјҢеҠ е…ҘNaOHжә¶ж¶Іе№¶еҠ зғӯпјҢдә§з”ҹеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“пјҢ并用ж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢж°”дҪ“пјҢиҜ•зәёеҸҳи“қпјҺ
ж №жҚ®д»ҘдёҠдәӢе®һеҲӨж–ӯпјҡ
-
пјҲ1пјү иӮҜе®ҡеӯҳеңЁзҡ„жҳҜпјӣ
-
пјҲ2пјү иӮҜе®ҡдёҚеӯҳеңЁзҡ„жҳҜпјӣ
-
пјҲ3пјү дёҚиғҪзЎ®е®ҡжҳҜеҗҰеӯҳеңЁзҡ„жҳҜпјҺиҜ·з®Җиҝ°иҜҒжҳҺиҜҘзү©иҙЁжҳҜеҗҰеӯҳеңЁзҡ„е®һйӘҢж–№жЎҲпјҲе®һйӘҢж–№жі•гҖҒзҺ°иұЎгҖҒз»“и®әпјүпјҺ
-
пјҲ4пјү еҶҷеҮәдёҠиҝ°е®һйӘҢв‘Јдёӯдә§з”ҹеҲәжҝҖжҖ§ж°”е‘іж°”дҪ“еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡпјҺ
йҳізҰ»еӯҗ | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
йҳҙзҰ»еӯҗ | OHп№Ј | Clп№Ј | CO32п№Ј | NO3п№Ј | SO42п№Ј |
еҲҶеҲ«еҸ–е®ғ们зҡ„ж°ҙжә¶ж¶ІиҝӣиЎҢе®һйӘҢпјҢз»“жһңеҰӮдёӢпјҡ
в‘ Aжә¶ж¶ІдёҺCжә¶ж¶Іж··еҗҲеҗҺдә§з”ҹи“қиүІжІүж·ҖпјҢеҗ‘иҜҘжІүж·ҖдёӯеҠ е…Ҙи¶ійҮҸзЁҖHNO3 пјҢ жІүж·ҖйғЁеҲҶжә¶и§ЈпјҢеү©дҪҷзҷҪиүІеӣәдҪ“пјӣ
в‘ЎBжә¶ж¶ІдёҺEжә¶ж¶Іж··еҗҲеҗҺдә§з”ҹзәўиӨҗиүІжІүж·ҖпјҢеҗҢж—¶дә§з”ҹеӨ§йҮҸж°”дҪ“пјӣ
в‘ўе°‘йҮҸCжә¶ж¶ІдёҺDжә¶ж¶Іж··еҗҲеҗҺдә§з”ҹзҷҪиүІжІүж·ҖпјҢиҝҮйҮҸCжә¶ж¶ІдёҺDжә¶ж¶Іж··еҗҲеҗҺж— зҺ°иұЎпјӣ
в‘ЈBжә¶ж¶ІдёҺDжә¶ж¶Іж··еҗҲеҗҺж— зҺ°иұЎпјӣ
в‘Өе°Ҷ38.4g CuзүҮжҠ•е…ҘиЈ…жңүи¶ійҮҸDжә¶ж¶Ізҡ„иҜ•з®ЎдёӯпјҢCuзүҮдёҚжә¶и§ЈпјҢеҶҚж»ҙеҠ 1.6molвҖўLп№Ј1зЁҖH2SO4 пјҢ CuйҖҗжёҗжә¶и§ЈпјҢз®ЎеҸЈйҷ„иҝ‘жңүзәўжЈ•иүІж°”дҪ“еҮәзҺ°пјҺ
-
пјҲ1пјү жҚ®жӯӨжҺЁж–ӯAгҖҒCзҡ„еҢ–еӯҰејҸдёәпјҡAпјӣCпјҺ
-
пјҲ2пјү еҶҷеҮәжӯҘйӘӨв‘ЎдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҺ
-
пјҲ3пјү Dжә¶ж¶Ідёӯж»ҙе…Ҙзҹіи•ҠиҜ•ж¶ІпјҢзҺ°иұЎжҳҜпјҢеҺҹеӣ жҳҜпјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиҜҙжҳҺпјүпјҺ
-
пјҲ4пјү жӯҘйӘӨв‘ӨдёӯиӢҘиҰҒе°ҶCuзүҮе®Ңе…Ёжә¶и§ЈпјҢиҮіе°‘еҠ е…ҘзЁҖH2SO4зҡ„дҪ“з§ҜжҳҜВ mLпјҺ
йҷҗйҖүиҜ•еүӮпјҡжө“зЎ«й…ёгҖҒ1.0molвҖўLп№Ј1HNO3гҖҒ1.0molвҖўLп№Ј1зӣҗй…ёгҖҒ1.0molвҖўLп№Ј1NaOHгҖҒ3%H2O2гҖҒ0.1molвҖўLп№Ј1KIгҖҒ0.1molвҖўLп№Ј1CuSO4гҖҒ20%KSCNгҖҒжҫ„жё…зҹізҒ°ж°ҙгҖҒж°§еҢ–й“ңгҖҒи’ёйҰҸж°ҙпјҺ
-
пјҲ1пјү иҜҘе°Ҹз»„еҗҢеӯҰжҹҘйҳ…иө„ж–ҷеҗҺжҺЁзҹҘпјҢеӣәдҪ“дә§зү©дёӯпјҢй“Ғе…ғзҙ дёҚеҸҜиғҪд»Ҙдёүд»·еҪўејҸеӯҳеңЁпјҢиҖҢзӣҗеҸӘжңүK2CO3 пјҺ йҖҡиҝҮеҸҜйӘҢиҜҒеӣәдҪ“дә§зү©дёӯжҳҜеҗҰеҗ«жңүй’ҫе…ғзҙ пјҺ
-
пјҲ2пјү еӣәдҪ“дә§зү©дёӯй“Ғе…ғзҙ еӯҳеңЁеҪўејҸзҡ„жҺўз©¶пјҺ
в‘ жҸҗеҮәеҗҲзҗҶеҒҮи®ҫпјҡ
еҒҮи®ҫ1пјҡе…ЁйғЁжҳҜй“ҒеҚ•иҙЁпјӣ
еҒҮи®ҫ2пјҡпјӣ
еҒҮи®ҫ3пјҡпјҺ
в‘Ўи®ҫи®Ўе®һйӘҢж–№жЎҲиҜҒжҳҺдҪ зҡ„еҒҮи®ҫ
в‘ўе®һйӘҢиҝҮзЁӢ
ж №жҚ®в‘Ўдёӯж–№жЎҲиҝӣиЎҢе®һйӘҢпјҺеңЁеҶҷеҮәе®һйӘҢжӯҘйӘӨгҖҒйў„жңҹзҺ°иұЎдёҺз»“и®әпјҺ
е®һйӘҢжӯҘйӘӨ
йў„жңҹзҺ°иұЎдёҺз»“и®ә
жӯҘйӘӨ1пјҡв‘
йғЁеҲҶеӣәдҪ“дёҚжә¶и§Ј
жӯҘйӘӨ2пјҡв‘Ў
в‘ў
жӯҘйӘӨ3пјҡ继з»ӯжӯҘйӘӨ2 дёӯзҡ„(2)пјҢиҝӣиЎҢеӣәж¶ІеҲҶзҰ»пјҢз”Ёи’ёйҰҸж°ҙжҙ—ж¶ӨиҮіжҙ—ж¶Өж¶Іж— иүІпјҢеҸ–е°‘йҮҸеӣәдҪ“дәҺиҜ•з®ЎдёӯпјҢж»ҙеҠ иҝҮйҮҸHClеҗҺпјҢйқҷзҪ®пјҢеҸ–дёҠеұӮе’Ңжё…ж¶ІпјҢж»ҙеҠ йҖӮйҮҸH2O2 пјҢ е……еҲҶжҢҜиҚЎеҗҺж»ҙеҠ KSCN
в‘Ј
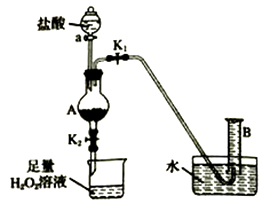
в‘ жЈҖйӘҢиҮӘжқҘж°ҙжҳҜеҗҰеҗ«ж°ҜзҰ»еӯҗв‘ЎйүҙеҲ«йЈҹзӣҗе’Ңе°ҸиӢҸжү“в‘ўиӣӢеЈіиғҪеҗҰжә¶дәҺй…ёв‘ЈзҷҪй…’дёӯжҳҜеҗҰеҗ«з”ІйҶҮ
| йҖүйЎ№ | е®һйӘҢзӣ®зҡ„ | ж“ҚдҪң |
| A | жҺўз©¶жҹҗеҚӨд»Јзғғдёӯзҡ„еҚӨеҺҹеӯҗ | е°ҶиҜҘеҚӨд»ЈзғғдёҺNaOHжә¶ж¶Іе…ұзғӯеҗҺпјҢеҗ‘ж··еҗҲж¶Ідёӯе…Ҳж»ҙеҠ HNO3жә¶ж¶Ій…ёеҢ–еҗҺж»ҙеҠ AgNO3жә¶ж¶І |
| B | е·Ҙдёҡд№ҷйҶҮеҲ¶еҸ–ж— ж°ҙд№ҷйҶҮ | еҠ еҗёж°ҙеүӮпјҲCaOпјүеҗҺеҶҚи’ёйҰҸ |
| C | иҜҒжҳҺз”ІиӢҜдёӯиӢҜзҺҜдҪҝз”Іеҹәзҡ„жҙ»жҖ§еўһејә | еҗ‘иҜ•з®ЎaдёӯеҠ е…Ҙ1 mLз”ІиӢҜпјҢеҠ е…ҘеҮ ж»ҙKMnO4й…ёжҖ§жә¶ж¶ІпјҢе……еҲҶжҢҜиҚЎпјӣеҗ‘зӣӣжңүйҖӮйҮҸKMnO4й…ёжҖ§жә¶ж¶Ізҡ„иҜ•з®ЎbдёӯйҖҡе…Ҙз”Ізғ· |
| D | жЈҖйӘҢи”—зі–ж°ҙи§Јдә§зү©е…·жңүиҝҳеҺҹжҖ§ | еҗ‘и”—зі–жә¶ж¶ІдёӯеҠ е…ҘеҮ ж»ҙзЁҖзЎ«й…ёпјҢж°ҙжөҙеҠ зғӯеҮ еҲҶй’ҹпјҢ然еҗҺеҗ‘е…¶дёӯеҠ е…Ҙж–°еҲ¶зҡ„ж°ўж°§еҢ–й“ңжӮ¬жөҠж¶ІпјҢ并еҠ зғӯ |
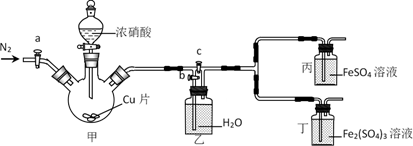

-
пјҲ1пјү иҜ•еүӮв‘ зҡ„дё»иҰҒжҲҗеҲҶзҡ„еҢ–еӯҰејҸжҳҜгҖӮ
-
пјҲ2пјү еҠ е…Ҙж–°еҲ¶ж°Ҝж°ҙеҗҺжә¶ж¶ІзәўиүІеҠ ж·ұзҡ„еҺҹеӣ жҳҜпјҲз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәпјүгҖӮ
-
пјҲ3пјү иҜҘеҗҢеӯҰеңЁе®һйӘҢдёӯеҠ е…ҘдәҶиҝҮйҮҸж°Ҝж°ҙпјҢж”ҫзҪ®дёҖж®өж—¶й—ҙеҗҺпјҢеҸ‘зҺ°ж·ұзәўиүІиӨӘеҺ»пјҢзҺ°еҜ№иӨӘиүІеҺҹеӣ иҝӣиЎҢжҺўз©¶гҖӮ
в‘ жҸҗеҮәеҒҮи®ҫ
еҒҮи®ҫ1пјҡжә¶ж¶Ідёӯзҡ„пјӢ3д»·й“Ғиў«ж°§еҢ–дёәжӣҙй«ҳд»·жҖҒзҡ„й“Ғпјӣ
еҒҮи®ҫ2пјҡгҖӮ
в‘Ўи®ҫи®Ўж–№жЎҲ
дёәдәҶеҜ№дҪ жүҖжҸҗеҮәзҡ„еҒҮи®ҫ2иҝӣиЎҢйӘҢиҜҒпјҢиҜ·еҶҷеҮәдёҖз§Қе®һйӘҢж–№жЎҲгҖӮ
-
пјҲ4пјү еә”з”ЁжӢ“еұ•
еҶҷеҮәе®һйӘҢе®ӨдҝқеӯҳFeSO4еӣәдҪ“зҡ„ж–№жі•гҖӮ
-
пјҲ1пјү иӢҘйҮҮз”Ёжө“ж°Ёж°ҙе’Ңз”ҹзҹізҒ°жқҘеҲ¶ж°Ёж°”пјҢйӮЈд№ҲдёӢйқўзҡ„еҸ‘з”ҹиЈ…зҪ®еӣҫдёӯеә”йҖүз”Ёзҡ„иЈ…зҪ®жҳҜ(еЎ«вҖңAвҖқжҲ–вҖңBвҖқ)

-
пјҲ2пјү е№ІзҮҘж°Ёж°”ж—¶пјҢеёёдҪҝз”Ёзҡ„е№ІзҮҘеүӮжҳҜ (еЎ«еҗҚз§°)гҖӮдёҚиғҪдҪҝз”Ёжө“зЎ«й…ёдҪңдёәж°Ёж°”е№ІзҮҘеүӮзҡ„еҺҹеӣ жҳҜпјҡгҖӮ
-
пјҲ3пјү з”Ёж°ҜеҢ–й“өе’Ңж°ўж°§еҢ–й’ҷеӣәдҪ“е…ұзғӯеҲ¶ж°Ёж°”ж—¶пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜпјҡгҖӮ
-
пјҲ4пјү иӢҘз”ЁйӣҶ气瓶收йӣҶж°Ёж°”пјҢжЈҖйӘҢж°Ёж°”жҳҜеҗҰ收йӣҶж»Ўзҡ„ж–№жі•жҳҜпјҡгҖӮ
-
пјҲ5пјү иӢҘйңҖиҰҒ收йӣҶж ҮеҶөдёӢ11.2Lзҡ„ж°Ёж°”пјҢеҲҷзҗҶи®әдёҠиҮіе°‘йңҖиҰҒж°ҜеҢ–й“өзҡ„иҙЁйҮҸжҳҜпјҡg(дҝқз•ҷдёӨдҪҚе°Ҹж•°)гҖӮ
|
|
|
|
AпјҺжЈҖйӘҢ | BпјҺжЈҖйӘҢжңүд№ҷзғҜз”ҹжҲҗ | CпјҺзҹіеўЁжҜ”йҮ‘еҲҡзҹізЁіе®ҡ | DпјҺжіЁе°„еҷЁзҡ„жҙ»еЎһеҸіз§»еҲҷиҜҘеҸҚеә”дёәж”ҫзғӯеҸҚеә” |
йҖүйЎ№ | е®һйӘҢеҶ…е®№ | йў„жөӢзҡ„е®һйӘҢзҺ°иұЎ |
A |
| дә§з”ҹзҷҪиүІжІүж·ҖеҗҺжІүж·Җж¶ҲеӨұ |
B |
| жә¶ж¶ІеҸҳиЎҖзәўиүІ |
C | AgIжӮ¬жөҠж¶Ідёӯж»ҙеҠ NaClжә¶ж¶ІиҮіиҝҮйҮҸ | й»„иүІжІүж·Җе…ЁйғЁиҪ¬еҢ–дёәзҷҪиүІжІүж·Җ |
D | й…ёжҖ§ | жә¶ж¶Ізҙ«зәўиүІиӨӘеҺ» |

е·ІзҹҘпјҡв‘ Fe(OH)3е®Ңе…ЁжІүж·ҖpHдёә3.2пјӣNi(OH)2ејҖе§ӢжІүж·ҖpHдёә7.2пјҢе®Ңе…ЁжІүж·ҖpHдёә9.2гҖӮ
в‘ЎNiCl2жҳ“ж°ҙи§ЈпјҢд»Һжә¶ж¶ІдёӯиҺ·еҸ–NiCl2В·6H2OйЎ»жҺ§еҲ¶pHпјң2гҖӮ
-
пјҲ1пјү еңЁдёүйўҲзғ§з“¶дёӯ(иЈ…зҪ®и§ҒеҰӮеӣҫ)еҠ е…ҘдёҖе®ҡйҮҸNiзІүе’Ңж°ҙпјҢйҖҡе…Ҙз©әж°”пјҢж»ҙе…ҘзЁҖзЎқй…ёе’ҢзЁҖзЎ«й…ёзҡ„ж··й…ёпјҢиҮіеҸҚеә”з»“жқҹпјҢиҝҮж»ӨпјҢеҲ¶еҫ—NiSO4жә¶ж¶ІгҖӮ

в‘ еҗ‘AиЈ…зҪ®дёӯйҖҡе…Ҙз©әж°”зҡ„дҪңз”ЁйҷӨжҗ…жӢҢеӨ–иҝҳжңүгҖӮ
в‘ЎиӢҘй•ҚзІүиҝҮйҮҸпјҢеҲӨж–ӯеҸҚеә”е®ҢжҲҗзҡ„зҺ°иұЎжҳҜгҖӮ
-
пјҲ2пјү е°ҶжүҖеҫ—NiSO4жә¶ж¶ІдёҺNaHCO3жә¶ж¶Іж··еҗҲеҸҚеә”еҫ—еҲ°NiCO3В·Ni(OH)2жІүж·ҖпјҢиҝҮж»ӨпјҢжҙ—ж¶ӨгҖӮ
в‘ жІүж·ҖеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
в‘ЎжЈҖйӘҢNiCO3В·Ni(OH)2жІүж·Җе·Із»Ҹжҙ—ж¶Өе®Ңе…Ёзҡ„ж–№жі•жҳҜгҖӮ
-
пјҲ3пјү жүҖеҫ—NiCO3В·Ni(OH)2еӣәдҪ“дёӯж··жңүе°‘йҮҸFe(OH)3гҖӮиҜ·иЎҘе……е®Ңж•ҙз”ұNiCO3В·Ni(OH)2еӣәдҪ“еҲ¶еӨҮNiCl2В·6H2Oзҡ„е®һйӘҢж–№жЎҲпјҡеҗ‘NiCO3В·Ni(OH)2еӣәдҪ“дёӯеҠ е…Ҙзӣҗй…ёпјҢжҗ…жӢҢпјҢ гҖӮ [NiCl2жә¶и§ЈеәҰжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮе®һйӘҢдёӯйЎ»йҖүз”Ёзҡ„д»ӘеҷЁе’ҢиҜ•еүӮпјҡpHи®ЎгҖҒзӣҗй…ёгҖҒNiCO3]

йҖүйЎ№ | е®һйӘҢж“ҚдҪң | е®һйӘҢзҺ°иұЎ | и§ЈйҮҠжҲ–з»“и®ә |
A | ж‘ҳдёӢеҮ ж №зҒ«жҹҙеӨҙжөёдәҺж°ҙдёӯпјҢдёҖе®ҡж—¶й—ҙеҗҺеҸ–йҖӮйҮҸжә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢеҠ | еҮәзҺ°зҷҪиүІжІүж·Җ | зҒ«жҹҙеӨҙеҗ«жңүж°Ҝе…ғзҙ |
B | еҗ‘ | з»ӣи“қиүІжә¶ж¶І | зүҷиҶҸдёӯеӯҳеңЁз”ҳжІ№ |
C | е°ҶзҹіиңЎжІ№дёҺзўҺз“·зүҮж··еҗҲеҠ ејәзғӯпјҢдә§з”ҹзҡ„ж°”дҪ“йҖҡе…Ҙй…ёжҖ§йҮҚ铬酸й’ҫй’ҫжә¶ж¶Ідёӯ | й…ёжҖ§йҮҚ铬酸й’ҫжә¶ж¶ІиӨӘиүІ | зҹіиңЎжІ№еҠ ејәзғӯдә§з”ҹзҡ„ж°”дҪ“жҳҜдёҚйҘұе’Ңзғғ |
D | еҸ– | зҷҪиүІжІүж·ҖиҪ¬еҢ–дёәй»„иүІжІүж·Җ |
|
йҖүйЎ№ | е®һйӘҢж“ҚдҪң | зҺ°иұЎ | з»“и®ә |
A | еҗ‘д№ҷйҶҮдёӯеҠ е…ҘдёҖе°ҸзІ’йҮ‘еұһй’ | дә§з”ҹж— иүІж°”дҪ“ | д№ҷйҶҮдёӯеҗ«жңүж°ҙ |
B | еҠ зғӯиҜ•з®Ўдёӯзҡ„иҒҡж°Ҝд№ҷзғҜи–„иҶңзўҺзүҮ | иҜ•з®ЎеҸЈж№ҝж¶Ұзҡ„и“қиүІзҹіи•ҠиҜ•зәёеҸҳзәў | ж°Ҝд№ҷзғҜеҠ иҒҡжҳҜеҸҜйҖҶеҸҚеә” |
C | еҗ‘иӣӢзҷҪиҙЁжә¶ж¶ІдёӯеҠ е…Ҙжө“ | жІүж·Җжә¶и§Ј | зӣҗжһҗдёҚз ҙеқҸиӣӢзҷҪиҙЁзҡ„жҙ»жҖ§ |
D | е°Ҷи”—зі–жә¶ж¶ІеңЁй…ёжҖ§жқЎд»¶дёӢеҠ зғӯдёҖж®өж—¶й—ҙеҗҺеҶҚдёҺж–°еҲ¶ж°ўж°§еҢ–й“ңжӮ¬жөҠж¶Іж··еҗҲеҠ зғӯ | жІЎжңүдә§з”ҹз –зәўиүІжІүж·Җ | и”—зі–жІЎжңүж°ҙи§ЈжҲ–ж°ҙи§Јдә§зү©жІЎжңүиҝҳеҺҹжҖ§ |
йҖүйЎ№ | е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎ | з»“и®ә |
A | еҗ‘жҹҗйЈҹзӣҗжә¶ж¶Ідёӯж»ҙеҠ ж·ҖзІүKIжә¶ж¶ІпјҢдёҚеҸҳи“қ | иҜҘйЈҹзӣҗдёӯдёҖе®ҡжІЎжңүж·»еҠ |
B | е°Ҷжҹҗжә¶ж¶ІдёҺзЁҖзӣҗй…ёеҸҚеә”дә§з”ҹзҡ„ж°”дҪ“йҖҡе…Ҙжҫ„жё…зҹізҒ°ж°ҙпјҢжҫ„жё…зҹізҒ°ж°ҙеҸҳжө‘жөҠ | иҜҘжә¶ж¶ІдёӯиҮіе°‘еҗ«жңү |
C | е°Ҷи„ұи„ӮжЈүж”ҫе…ҘиҜ•з®ЎдёӯпјҢеҠ е…Ҙжө“зЎ«й…ёжҗ…жҲҗзіҠзҠ¶пјҢеҫ®зғӯеҫ—еҲ°дә®жЈ•иүІжә¶ж¶ІпјҢеҠ е…Ҙ银氨жә¶ж¶Іе№¶ж°ҙжөҙеҠ зғӯпјҢдёҖж®өж—¶й—ҙеҗҺжңӘи§ӮеҜҹеҲ°й“¶й•ң | и„ұи„ӮжЈүжңӘж°ҙи§Ј |
D | еҗ‘жҹҗжңүжңәзү©дёӯеҠ е…Ҙж–°еҲ¶ | иҜҘжңүжңәзү©дёӯеҗ«жңү |
-
пјҲ1пјү ж·Ўй»„иүІеӣәдҪ“дёә(еЎ«еҢ–еӯҰејҸ)пјҢеҶҷеҮәз”ҹжҲҗиҜҘзү©иҙЁзҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ2пјү дёәйӘҢиҜҒдә§зү©з”ІеҗҢеӯҰи®ҫи®ЎдәҶеҰӮдёӢе®һйӘҢпјҢе…¶иЈ…зҪ®еҰӮеӣҫжүҖзӨәгҖӮBдёӯзӣӣж”ҫзҮғзғ§дә§зү©пјҢAдёӯзӣӣж”ҫж°ҙпјҢжү“ејҖAзҡ„жҙ»еЎһи®©ж°ҙжөҒдёӢпјҢи§ӮеҜҹеҲ°BдёӯеҸ‘з”ҹеҸҚеә”пјҢйӣҶ气瓶дёӯзҡ„ж°ҙйҖҡиҝҮеҜјз®ЎжҺ’е…ҘйҮҸзӯ’дёӯгҖӮ

в‘ д»ӘеҷЁAзҡ„еҗҚз§°дёәпјӣ
в‘ЎеҶҷеҮәд»ӘеҷЁBдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
-
пјҲ3пјү д№ҷеҗҢеӯҰи§ӮеҜҹеҲ°Bдёӯй»‘иүІзү©иҙЁдёҚжә¶и§ЈпјҢз”ұжӯӨжҺЁжөӢзҮғзғ§дә§зү©дёӯжңүеӨҡз§Қзү©иҙЁгҖӮйҖҡиҝҮжҹҘйҳ…иө„ж–ҷпјҢд»–дәҶи§ЈеҲ°NaдёҺCO2еҸҜд»ҘеҸ‘з”ҹеҸҚеә”з”ҹжҲҗзўіеҚ•иҙЁе’ҢNa2CO3еӣәдҪ“гҖӮ
дёәжЈҖжөӢдёҠиҝ°зҮғзғ§дә§зү©дёӯжҳҜеҗҰеӯҳеңЁNa2CO3еӣәдҪ“пјҢд№ҷеҗҢеӯҰи®ҫи®ЎдәҶд»ҘдёӢе®һйӘҢж–№жЎҲпјҢиҜ·дҪ иЎҘе…ЁиҜҘе®һйӘҢпјҡ
е®һйӘҢж“ҚдҪң
е®һйӘҢзҺ°иұЎ
е®һйӘҢз»“и®ә
ж–№жЎҲдёҖ
еҸ–Bдёӯжә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢеҫҖе…¶дёӯж»ҙе…ҘеҮ ж»ҙй…ҡй…һ
жә¶ж¶ІеҸҳзәў
зҮғзғ§дә§зү©дёӯжңүNa2CO3еӣәдҪ“
ж–№жЎҲдәҢ
еҸ–Bдёӯжә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢеҫҖе…¶дёӯеҠ е…ҘCaCl2жә¶ж¶І
дёҷеҗҢеӯҰи®Өдёәж–№жЎҲдёҖдёҚеҗҲзҗҶпјҢе…¶зҗҶз”ұжҳҜгҖӮ
з»ҸиҝҮи®Ёи®әпјҢеӨ§е®¶еҸҲжҸҗеҮәдәҶеҗҲзҗҶзҡ„ж–°ж–№жЎҲ(еҗ«е®һйӘҢж“ҚдҪңпјҢзҺ°иұЎе’Ңз»“и®ә)гҖӮ


 дёӯжҳҜеҗҰж··жңүжәҙи’ёж°”
дёӯжҳҜеҗҰж··жңүжәҙи’ёж°” жә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІиҮіиҝҮйҮҸ
жә¶ж¶Ідёӯж»ҙеҠ NaOHжә¶ж¶ІиҮіиҝҮйҮҸ жә¶ж¶Ідёӯж»ҙеҠ KSCNжә¶ж¶І
жә¶ж¶Ідёӯж»ҙеҠ KSCNжә¶ж¶І жә¶ж¶Ідёӯж»ҙеҠ д№ҷйҶҮиҮіиҝҮйҮҸ
жә¶ж¶Ідёӯж»ҙеҠ д№ҷйҶҮиҮіиҝҮйҮҸ жә¶ж¶ІгҖҒзЁҖзЎқй…ёе’Ң
жә¶ж¶ІгҖҒзЁҖзЎқй…ёе’Ң жә¶ж¶ІгҖӮ
жә¶ж¶ІгҖӮ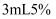 зҡ„
зҡ„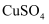 жә¶ж¶ІдёӯеҠ е…ҘеҮ ж»ҙ
жә¶ж¶ІдёӯеҠ е…ҘеҮ ж»ҙ жә¶ж¶ІпјҢеҲ¶еҫ—ж–°еҲ¶
жә¶ж¶ІпјҢеҲ¶еҫ—ж–°еҲ¶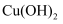 然еҗҺеҠ е…ҘйҖӮйҮҸзүҷиҶҸ
然еҗҺеҠ е…ҘйҖӮйҮҸзүҷиҶҸ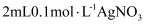 жә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢж»ҙеҠ
жә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢж»ҙеҠ  жә¶ж¶ІпјҢеҫ…дёҚеҶҚеҮәзҺ°зҷҪиүІжІүж·ҖеҗҺпјҢеҶҚж»ҙеҠ
жә¶ж¶ІпјҢеҫ…дёҚеҶҚеҮәзҺ°зҷҪиүІжІүж·ҖеҗҺпјҢеҶҚж»ҙеҠ  жә¶ж¶І
жә¶ж¶І жә¶и§ЈеәҰеӨ§дәҺ
жә¶и§ЈеәҰеӨ§дәҺ
 жә¶ж¶ІпјҢеҸ–жһҗеҮәзҡ„жІүж·ҖеҸҰеҠ и’ёйҰҸж°ҙ
жә¶ж¶ІпјҢеҸ–жһҗеҮәзҡ„жІүж·ҖеҸҰеҠ и’ёйҰҸж°ҙ
 жҲ–
жҲ–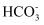 дёӯзҡ„дёҖз§Қ
дёӯзҡ„дёҖз§Қ



