溶液pH的定义 知识点题库
向一定体积的饱和石灰水中加入少量生石灰,并恢复到原状况。则下列叙述正确的是
A . 溶液的pH增大
B . 溶液的pH减小
C . 溶液中Ca2+浓度保持不变
D . 溶液中Ca2+物质的量保持不变
纯水在20℃的pH (填“大于”或“小于”)80℃时的pH.
现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH,且已知:CO2+3H2O+2AlO2﹣═2Al(OH)3↓+CO32﹣ .
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是 (填编号).
(2)将上述物质的量浓度均为0.1mol/L的五种溶液稀释相同倍数时,其pH变化最大的是 (填编号).
(3)在上述五种电解质溶液中分别加入AlCl3溶液,无气体产生的是 (填编号)
(4)将上述①、②、③、④这四种电解质溶液混合,发生反应的离子方程式为 .
下列溶液肯定呈酸性的是( )
A . 含H+的溶液
B . 加酚酞显无色的溶液
C . pH<7的溶液
D . c(OH+)<c(H+)的溶液
关于溶液的酸碱性说法正确的是( )
A . c(H+)很小的溶液一定呈碱性
B . pH=7的溶液一定呈中性
C . c(OH﹣)=c(H+)的溶液一定呈中性
D . 不能使酚酞试液变红的溶液一定呈酸性
下列说法正确的是( )
A . 常温时,pH=12的溶液加水后,pH一定不小于7
B . 酸性氧化物加在水中,然后滴加紫色石蕊试液后一定呈红色
C . 打开汽水瓶盖有气泡逸出,此时饱和溶液变成了不饱和溶液
D . 非金属氧化物一定是酸性氧化物
下列说法正确的是( )
A . pH=6.8的溶液一定显酸性
B . 相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4 , 则c(NH4+)由大到小的顺序是:①>②>③
C . 电离平衡常数(K)只与弱电解质本身有关,与其它外部因素无关
D . 0.1 mol•L﹣1的硫化钠溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HS﹣)+c(S2﹣)
下列溶液一定呈中性的是( )
A . pH=7的溶液
B . c(H+)=c(OH-)=10-6mol/L溶液
C . 使石蕊试液呈紫色的溶液
D . 等体积等浓度的酸与碱反应后的溶液
常温下,0.05 mol/L稀硫酸中OH-浓度是(mol/L)( )
A . 1×10-12
B . 2×10-12
C . 1×10-13
D . 2×10-13
25℃时,体积均为25.00mL,浓度均为0.0100mo1•L-1的HA、H3B溶液分别用0.0100mo1•L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )

A . 25℃时,0.0100mo1•L-1Na2HB溶液的pH>7
B . 向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C . NaOH溶液滴定HA溶液应选甲基橙作指示剂
D . 25℃时,H2B-离子的水解常数的数量级为10-3
已知甲、乙、丙、丁四种溶液分别为CH3COONa、NH3•H2O、CH3COOH、Na2SO4中的一种,相同温度下,甲与乙两种溶液的pH相同,甲与丙两种溶液中的水的电离程度相同,则丁为( )
A . NH3•H2O
B . CH3COONa
C . CH3COOH
D . Na2SO4
常温下,浓度均为 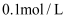 的4种钠盐溶液pH如下:下列说法错误的是( )
的4种钠盐溶液pH如下:下列说法错误的是( )
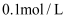 的4种钠盐溶液pH如下:下列说法错误的是( )
的4种钠盐溶液pH如下:下列说法错误的是( ) | 溶质 | | | NaClO | |
| pH | | | | |
A . 四种溶液中,  溶液中水的电离程度最大
B .
溶液中水的电离程度最大
B .  溶液显酸性的原因是:
溶液显酸性的原因是:  C . 向氯水中加入少量
C . 向氯水中加入少量  ,可以增大氯水中次氯酸的浓度
D . 常温下,相同物质的量浓度的
,可以增大氯水中次氯酸的浓度
D . 常温下,相同物质的量浓度的 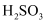 、
、  、HClO,pH最小的是
、HClO,pH最小的是 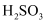
 溶液中水的电离程度最大
B .
溶液中水的电离程度最大
B .  溶液显酸性的原因是:
溶液显酸性的原因是:  C . 向氯水中加入少量
C . 向氯水中加入少量  ,可以增大氯水中次氯酸的浓度
D . 常温下,相同物质的量浓度的
,可以增大氯水中次氯酸的浓度
D . 常温下,相同物质的量浓度的 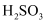 、
、  、HClO,pH最小的是
、HClO,pH最小的是 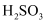
下列溶液:①CH3COOH ②HCl ③NaOH ④CH3COONa ⑤KCl ⑥NH4Cl其物质的量浓度均为0.1mol/L,其pH由大到小排列顺序为( )
A . ③④⑤⑥①②
B . ④⑤⑥①③②
C . ②①⑥⑤④③
D . ②③①⑥⑤④
下列关于氨水的说法正确的是( )
A . 氨水是碱,其中不含H+
B . 氨水的导电性比 NaOH溶液弱
C . 室温下的稀氨水中,Kw= 1×10-14
D . 某瓶氨水的pH=9,说明氨水是弱电解质
对于0.1 mol·L-1 NH4Cl溶液,正确的是( )
A . 升高温度,溶液pH升高
B . 通入少量HCl气体,c(NH4+)和c(Cl-)均增大
C . c(NH4+)+ c(OH-)=c(Cl-)+ c(H+)
D . c(Cl-)> c(H+)> c(NH4+)> c(OH-)
下列说法错误的是( )
A .  的溶液不一定呈酸性
B . 中和
的溶液不一定呈酸性
B . 中和  和体积均相等的氨水、
和体积均相等的氨水、  溶液,所需
溶液,所需  的物质的量相同
C . 相同温度下,
的物质的量相同
C . 相同温度下,  相等的盐酸、
相等的盐酸、  溶液中,
溶液中,  相等
D . 氨水和盐酸反应后的溶液,若溶液呈中性,则
相等
D . 氨水和盐酸反应后的溶液,若溶液呈中性,则 
 的溶液不一定呈酸性
B . 中和
的溶液不一定呈酸性
B . 中和  和体积均相等的氨水、
和体积均相等的氨水、  溶液,所需
溶液,所需  的物质的量相同
C . 相同温度下,
的物质的量相同
C . 相同温度下,  相等的盐酸、
相等的盐酸、  溶液中,
溶液中,  相等
D . 氨水和盐酸反应后的溶液,若溶液呈中性,则
相等
D . 氨水和盐酸反应后的溶液,若溶液呈中性,则 
25℃时,下列说法正确的是( )
A . 将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,若溶液中c(NH  )=c(Cl-),则氨水的电离平衡常数
)=c(Cl-),则氨水的电离平衡常数  B . pH=3和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍
C . NaHS溶液中存在如下关系:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D . 浓度均为0.1mol·L-1的Na2CO3和CH3COONa溶液,后者pH大
B . pH=3和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍
C . NaHS溶液中存在如下关系:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D . 浓度均为0.1mol·L-1的Na2CO3和CH3COONa溶液,后者pH大
 )=c(Cl-),则氨水的电离平衡常数
)=c(Cl-),则氨水的电离平衡常数  B . pH=3和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍
C . NaHS溶液中存在如下关系:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D . 浓度均为0.1mol·L-1的Na2CO3和CH3COONa溶液,后者pH大
B . pH=3和pH=4的醋酸溶液,醋酸浓度前者是后者的10倍
C . NaHS溶液中存在如下关系:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D . 浓度均为0.1mol·L-1的Na2CO3和CH3COONa溶液,后者pH大
下列实验能达到预期目的的是( )
实验内容 | 实验目的 | |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18 mol·L-1和0.1 mol·L-1H2SO4溶液的pH | 比较不同浓度硫酸的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有2 mL 0.01 mol·L-1 AgNO3溶液的试管中滴加2滴0.01 mol·L-1 NaCl溶液,有白色沉淀生成,再向其中滴加 2滴0.01 mol·L-1 NaI溶液,产生黄色沉淀 | 证明在相同温度下Ksp(AgCl)>Ksp(AgI) |
A . A
B . B
C . C
D . D
下列事实不能用勒夏特列原理解释的是( )
A . 常温下将 的醋酸溶液稀释10倍,pH<5
B .
的醋酸溶液稀释10倍,pH<5
B .  被
被 氧化为
氧化为 的反应,往往需要使用催化剂
C . 利用
的反应,往往需要使用催化剂
C . 利用 水解制备
水解制备 时,需加入大量水并加热
D . 向
时,需加入大量水并加热
D . 向 悬浊液中滴加
悬浊液中滴加 溶液,有红褐色沉淀生成
溶液,有红褐色沉淀生成
 的醋酸溶液稀释10倍,pH<5
B .
的醋酸溶液稀释10倍,pH<5
B .  被
被 氧化为
氧化为 的反应,往往需要使用催化剂
C . 利用
的反应,往往需要使用催化剂
C . 利用 水解制备
水解制备 时,需加入大量水并加热
D . 向
时,需加入大量水并加热
D . 向 悬浊液中滴加
悬浊液中滴加 溶液,有红褐色沉淀生成
溶液,有红褐色沉淀生成
H3PO2是一种一元弱酸,与等浓度等体积的NaOH完全反应后生成NaH2PO2 , 下列叙述正确的是( )
A . NaH2PO2的溶液呈碱性
B . 0.01mol/LH3PO2水溶液加水稀,pH减小
C . H3PO2溶液中存在电离平衡: D . 0.01mol/L
D . 0.01mol/L 溶液中存在:
溶液中存在:
 D . 0.01mol/L
D . 0.01mol/L 溶液中存在:
溶液中存在:
最近更新








