溶液pH的定义 知识点题库
已知某温度下,K(HCN)= 6.2×10-10 mol·L-1、K(HF)= 6.8×10-4 mol·L-1、K(CH3COOH)= 1.8×10-5 mol·L-1、、K(HNO2)= 6.4×10-6mol·L-1。物质的量浓度均为0.1 mol·L-1的下列溶液中,pH最小的是( )
A . NaCN
B . NaF
C . CH3COONa
D . NaNO2
下列说法正确的是( )
A . pH<7的溶液一定显酸性
B . 25℃时,pH=5的溶液与pH=3的溶液相比,前者c(OH-)是后者的100倍
C . 室温下,每1×107个水分子中只有一个水分子发生电离
D . 在0.1mol/L的氨水中,改变外界条件使c(NH4+)增大,则溶液的pH一定增大
下列关于pH变化的判断正确的是( )
A . 随着温度的升高,Na2CO3溶液pH减小
B . 随着温度的升高,纯水的pH增大
C . 新制氯水经光照一段时间后,溶液pH减小
D . 氢氧化钠溶液久置于空气中,溶液pH变大
能说明溶液呈中性的可靠依据是( )
A . pH=7
B . c(H+)=c(OH﹣)
C . pH试纸不变色
D . 石蕊试液不变色
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
A . 在③④中分别加入适量的醋酸铵晶体后,③的pH减小,④的pH不变
B . 温度上升10℃,四种溶液的pH均不变(不考虑发挥与分解)
C . 分别加水稀释10倍,四种溶液的pH为①>②>④>③
D . 将①④两种溶液等体积混合,所得溶液中c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
已知温度T时水的离子积常数为Kw . 该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1的NaOH等体积混合,混合溶液中c(H+)=![]() mol•L﹣1 . 下列说法不正确的是( )
mol•L﹣1 . 下列说法不正确的是( )
A . 混合溶液呈中性
B . a≥b
C . 混合溶液中,c(A﹣)=c(Na+)
D . 混合液中水电离出c(OH﹣)大于该温度下纯水电离出c(OH﹣)
下列水溶液一定呈中性的是( )
A . pH=7的溶液
B . c(H+)=1.0×10﹣7mol•L﹣1的溶液
C . c(H+)=c(OH﹣)
D . pH=3的酸与pH=11的碱等体积混合后的溶液
下列溶液一定呈中性的是( )
A . pH=7的溶液
B . 由强酸、强碱等物质的量反应制得的溶液
C . c(H+)=c(OH﹣)的溶液
D . 非电解质溶于水得到的溶液
已知某温度下,四种一元弱酸的电离平衡常数为:Ka(HCN)= 6.2×10-10mol/L、Ka(HF)= 6.8×10-4mol/L、Ka(CH3COOH)= 1.8×10-5mol/L、Ka(HNO2)= 6.4×10-6mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是( )
A . HCN
B . CH3COOH
C . HF
D . HNO2
常温下,下列溶液的离子浓度关系式正确的是( )
A . pH=4的氯化铵溶液中:c(H+)= c(NH3·H2O )=1×10-4mol·L-1
B . pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<②
C . pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-)
D . pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1
现有pH=5的CH3COOH溶液10 mL,要使pH增大3,可采取的方法有( )
A . 向溶液中加水稀释至10 L
B . 加入一定量的NaOH固体
C . 加入一定量pH=8的NaOH溶液
D . 加入一定浓度的盐酸
25 ℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
A . 中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积
B . 往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全
C . 将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-)
D . 25 ℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol·L-1
下列说法错误的是( )
A . MCl2在水溶液中的电离方程式为:MCl2=M2++2Cl− , 则M(OH)2可能是弱电解质
B . 足量的锌分别与等体积、等pH的盐酸和醋酸反应,相同条件下产生氢气体积相同
C . 已知,H2A=H++HA− , HA−⇌H++A2− , 则NaHA溶液呈酸性
D . 相同温度下,pH相等的氨水和氢氧化钠溶液中,c(NH  )=c(Na+)
)=c(Na+)
 )=c(Na+)
)=c(Na+)
一定温度下,向10ml0.1mol/L的醋酸溶液和10ml0.1mol/L的盐酸中投入足量相同大小的锌粒,下列说法正确的是( )
A . 反应起始速率相等
B . 生成的H2质量相等
C . 原溶液的pH相等
D . 盐酸生成的H2多
下列叙述错误的是( )
A . 酸雨的pH小于5.6
B . 能用浓硫酸干燥二氧化硫气体
C . 铁粉与硫粉反应生成硫化亚铁是放热反应
D . 锌锰干电池中,锌筒作正极
草酸钴用途广泛,可用于指示剂和催化剂的制备。用含钴废料(主要成分为  ,还含有一定量的
,还含有一定量的  、
、  、
、  、
、 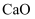 、
、  等)制备草酸钴晶体
等)制备草酸钴晶体  的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:
 ,还含有一定量的
,还含有一定量的  、
、  、
、  、
、 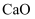 、
、  等)制备草酸钴晶体
等)制备草酸钴晶体  的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题: 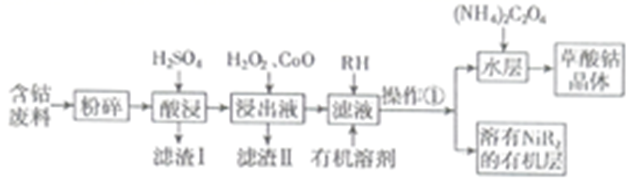
已知:①草酸钴晶体难溶于水
② 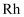 为有机物(难电离)
为有机物(难电离)
③相关金属离子 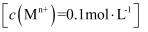 形成氢氧化物沉淀的
形成氢氧化物沉淀的  范围如下:
范围如下:
| 金属离子 | | | | |
| 开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
| 沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
-
(1) 滤渣Ⅰ的成分。
-
(2)
 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入  后溶液中发生的主要反应的离子方程式。
后溶液中发生的主要反应的离子方程式。
-
(3) 加入氧化钴调节浸出液的
 的范围是。
的范围是。
-
(4) 加入有机溶剂的目的是。
-
(5) 若仅从沉淀转化角度考虑,能否利用反应
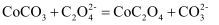 将
将 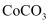 转化为
转化为  (填“能”或“不能”),说明理由:。(已知
(填“能”或“不能”),说明理由:。(已知  ,
,  )
)
-
(6) 为测定制得的草酸钴晶体样品的纯度,现称取样品
 ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液  。移取
。移取 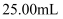 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用 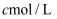 高锰酸钾溶液滴定,当溶液由(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由(填颜色变化),消耗高锰酸钾溶液 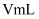 ,计算草酸钴晶体样品的纯度为
,计算草酸钴晶体样品的纯度为 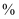 。(用含
。(用含 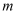 、
、 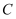 、
、 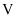 的代数式表示)(已知
的代数式表示)(已知  的摩尔质量为
的摩尔质量为 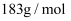 )
)
在常温条件下,下列说法错误的是( )
A .  的盐酸中
的盐酸中  B . 将
B . 将  溶液从常温加热至
溶液从常温加热至 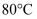 ,溶液的
,溶液的  变小但仍保持中性
C .
变小但仍保持中性
C . 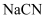 溶液呈碱性,说明
溶液呈碱性,说明 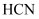 是弱电解质
D .
是弱电解质
D .  为3的醋酸溶液中加入醋酸的固体,溶液
为3的醋酸溶液中加入醋酸的固体,溶液  增大
增大
 的盐酸中
的盐酸中  B . 将
B . 将  溶液从常温加热至
溶液从常温加热至 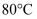 ,溶液的
,溶液的  变小但仍保持中性
C .
变小但仍保持中性
C . 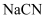 溶液呈碱性,说明
溶液呈碱性,说明 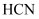 是弱电解质
D .
是弱电解质
D .  为3的醋酸溶液中加入醋酸的固体,溶液
为3的醋酸溶液中加入醋酸的固体,溶液  增大
增大
最近《科学》杂志评出10大科技突破,其中“火星上找到水的影子”名列第一、下列关于水的说法中正确的是( )
A . 水的电离过程需要通电
B . 加入电解质一定会破坏水的电离平衡
C .  的水一定呈中性
D . 升高温度,纯水的
的水一定呈中性
D . 升高温度,纯水的 值变小
值变小
 的水一定呈中性
D . 升高温度,纯水的
的水一定呈中性
D . 升高温度,纯水的 值变小
值变小
最近更新