铵离子检验 知识点题库
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
实验目的 | 实验操作 | 实验原理 | |
A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+ |

 有白色沉淀,说明原溶液中有Cl-
B . 某溶液
有白色沉淀,说明原溶液中有Cl-
B . 某溶液  有蓝色沉淀,说明原溶液中有Cu2+
C . 某溶液
有蓝色沉淀,说明原溶液中有Cu2+
C . 某溶液  有白色沉淀,说明原溶液中有SO42-
D . 某溶液
有白色沉淀,说明原溶液中有SO42-
D . 某溶液  生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
| 选项 | 操作 | 现象 | 结论 |
| A | 某无色溶液中滴入几滴酚酞溶液 | 溶液变红 | 该溶液一定为碱溶液 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| C | 某无色溶液中滴加足量NaOH溶液并加热,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中有NH4+ |
| D | 灼烧某白色粉末 | 火焰呈黄色 | 则证明该粉末中肯定有Na+ , 无K+ |
-
(1) 写出氮元素的原子结构示意图:。
-
(2) 通常情况下,氮气性质不活泼,其原因是__________。A . 氮分子是双原子分子 B . 氮元素的非金属性很强 C . 氮原子的半径较小 D . 破坏氮分子中的化学键很难
-
(3) N2的电子式:,将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是。
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
-
(4) 氨气的电子式:。
-
(5) 实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出此反应的化学方程式。
-
(6) 下面是实验室制取氨气的装置和选用的试剂,其中不正确是。
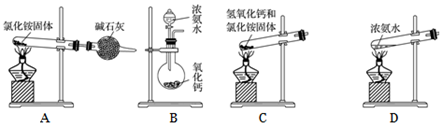
-
(7) 收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。
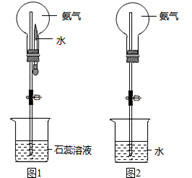
-
(8) 用圆底烧瓶收集干燥的氨气,用图1装置进行喷泉实验,挤压滴管的胶头时,可以得到红色喷泉,原因(用方程式表示) 。
-
(9) 如果只提供如图2的装置,请说明引发喷泉的方法。
-
(10) NH4NO3是常用的铵态氮肥,在施用时若受热会释放出而降低肥效。检验NH4+的方法是。

资料:①CH3COONH4溶液呈中性。
②Cl-对该反应几乎无影响。
|
实验 |
实验试剂 |
实验现象 |
|
1 |
5mL蒸馏水 |
反应缓慢,有少量气泡产生(经检验为H2) |
|
2 |
5mL 1.0 mol/L NH4Cl溶液(pH=4.6) |
剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
-
(1) 经检验实验2中刺激性气味气体为NH3 , 检验方法是。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
-
(2) 已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3 , 再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有,灰白色固体可能是(填化学式)。
-
(3) 甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是。
-
(4) 乙同学通过实验3证明甲同学的说法不合理。
实验
实验装置
3

①试剂X是 。
②由实验3获取的证据为 。
-
(5) 为进一步探究实验2反应剧烈的原因,进行实验4。
实验
实验试剂
实验现象
4
5 mL NH4Cl乙醇溶液
有无色无味气体产生(经检验为H2)
依据上述实验,可以得出Mg能与
 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是。
反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是。 -
(6) 由以上实验可以得出的结论是。
| 选项 | 实验操作 | 现象 | 结论 |
| A | 取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,透过蓝色钴玻璃观察 | 火焰呈紫色 | 溶液为钾盐 |
| B | 向Fe(NO3)2样品溶液中加入稀硫酸,然后再滴入KSCN溶液 | 溶液呈血红色 | Fe(NO3)2已变质 |
| C | 向溶液中加入盐酸酸化的氯化钡溶液 | 产生白色沉淀 | 溶液中含有 |
| D | 向某溶液中加入足量NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 试纸变蓝色 | 溶液中含有 |
| 选项 | 实验操作 | 实验现象 | 实验推论 |
| A | 向某溶液中加入 | 未产生能使湿润红色石蕊试纸变蓝的气体 | 原溶液中不含有 |
| B | 测定饱和 | 前者 | |
| C | 向红热的木炭滴加浓硝酸 | 产生大量的红棕色气体 | 木炭和浓硝酸反应生成 |
| D | 向 | 有白色沉淀生成,四氯化碳层呈紫色 | 白色沉淀可能为 |

-
(1) 下列关于海洋中氮循环的说法错误的是(填字母)。
a.海洋中只存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.②中的含氮物质转化属于氮的固定化作用
d.向海洋排放含
 的废水会影响海洋中
的废水会影响海洋中  的含量
的含量 -
(2) 检验某溶液中是否含有
 的方法是 。
的方法是 。
-
(3) 铜与稀硝酸反应的离子方程式为 ,该反应体现了稀硝酸的性。
-
(4) 有氧时,在硝化细菌作用下
 可实现过程④的转化,将过程④的离子方程式补充完整并配平。 NH
可实现过程④的转化,将过程④的离子方程式补充完整并配平。 NH  +5O2⟶2NO
+5O2⟶2NO  +H++
+H++
该反应中每消耗0.05 mol
 ,转移电子的数目为 。
,转移电子的数目为 。
 或
或 B . 向某溶液中加入
B . 向某溶液中加入 有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有
有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有 C . 某固态化合物用适量水溶解、冷却后滴加
C . 某固态化合物用适量水溶解、冷却后滴加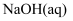 , 未产生使湿润红色石蕊试纸变蓝的气体,则该化合物中不含
, 未产生使湿润红色石蕊试纸变蓝的气体,则该化合物中不含 D . 向某溶液中加入
D . 向某溶液中加入 产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有
产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定有
 B . 向溶液中加入稀硝酸后,再加入
B . 向溶液中加入稀硝酸后,再加入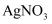 溶液有白色沉淀生成,则溶液中一定含有
溶液有白色沉淀生成,则溶液中一定含有 C . 加入
C . 加入 溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液中一定含有
溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液中一定含有 D . 向溶液中加入
D . 向溶液中加入 溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推该溶液中一定含有
溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推该溶液中一定含有


 溶液
溶液 溶液和饱和
溶液和饱和  溶液的
溶液的  值
值 的水解程度小于
的水解程度小于 

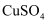 溶液中加入
溶液中加入 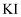 溶液,再加入四氯化碳振荡
溶液,再加入四氯化碳振荡