硝酸的化学性质 知识点
硝酸的化学性质:是指硝酸在与其它物质发生反应时表现出来的性质,硝酸常表现酸性、强氧化性,可与碱、还原性的物质发生反应。
硝酸的化学性质 知识点题库
NaNO2有像食盐一样的外观和咸味,它对人体的毒性表现为:可将正常的血红蛋白变为高铁血红蛋白(使血红蛋白中的铁元素由二价变为三价),失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂.下列有关NaNO2毒性分析正确的是( )
A . 因解毒剂美蓝具有氧化性
B . 中毒时亚硝酸盐发生氧化反应
C . 解毒时高铁血红蛋白被还原
D . 中毒时血红蛋白分子被还原
在食品工业或餐饮业中使用量特别要注意严加控制的物质是( )
A . 氯化钠
B . 谷氨酸钠
C . 蔗糖
D . 亚硝酸钠
越来越多的食品问题所造成的危害有目共睹,给我们敲响了警钟.一些“毒奶粉”竟然顶着国家“免检产品”桂冠.某品牌奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌.NaNO2有像食盐一样的咸味,能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O.
-
(1) 上述反应中氧化剂是 ,若有1.75mol的还原剂被氧化,则被还原的氧化剂是 mol.
-
(2) 根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋、⑥白酒.进行实验时,必须选用的物质有 .(填编号)
-
(3) 某厂废切削液中,含2%~5%的NaNO2 , 直接排放会造成污染,下列试剂 能使NaNO2转化为不引起二次污染的N2 . (填编号)①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
反应的化学方程式为
制备相同质量的硝酸铜,从经济效益和环保角度考虑,最适宜采用的方法是( )
A . Cu+HNO3(浓)→Cu(NO3)2
B . Cu+HNO3(稀)→Cu(NO3)2
C . Cu+AgNO3→Cu(NO3)2
D . Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
 CuO
CuO  Cu(NO3)2
Cu(NO3)2
下列叙述正确的是( )
A . 常温下NO2是无色气体,能与水发生反应
B . SiO2难溶于水,不能与NaOH溶液反应
C . 浓硝酸能与铜反应生成H2
D . 实验室常用NH4Cl和Ca(OH)2固体混合物加热来制取NH3
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出.该盐是( )
A . Fe2(SO4)3
B . KNO3
C . FeSO4
D . Na2CO3
常温下,下列不发生反应的一组物质是( )
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与水⑤铁与液氯 ⑥一氧化氮与氧气 ⑦硅与氧气 ⑧H2S与SO2 .
A . ①②③⑥
B . ②③⑥⑧
C . ①④⑤⑦
D . ①②③⑦
在某 100mL 混合酸中,HNO3 物质的量浓度为 0.4mol/L,H2SO4 物质的量浓度为0.2mol/L。向其中加入 1.92g 铜粉微热,待充分反应后,溶液中 Cu2+物质的量浓度约为( )
A . 0.15mol/L
B . 0.3mol/L
C . 0.225mol/L
D . 无法计算
将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:(要写计算过程)
-
(1) NO的体积为L,NO2的体积为L;(保留2位有效数字)
-
(2) 待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为mol·L-1。(列出计算式即可)
将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A . 表中V=7.84 L
B . 原混合物粉末的质量为25.6 g
C . 原混合物粉未中铁和铜的物质的量之比为2:3
D . 实验3所得溶液中硝酸的物质的量浓度为0.875 mol•L﹣1
将一定量的由Cu和Cu2O组成的混合粉末加入到125mL2.6mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到VmL(标准状况)的纯净无色气体Y。下列结论正确的是
A . X中有两种溶质
B . Y通入纯水中得到酸性溶液
C . 原混合粉末的总质量小于7.8g
D . 当V=1680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液的颜色变化应该是( )
A . 颜色变浅
B . 逐渐变为红色
C . 没有改变
D . 变为棕黄色
下列现象或事实可用同一化学原理解释的是( )
A . 氯气和二氧化硫都能使品红溶液褪色
B . 常温下,可以用铁铝制容器贮存浓硫酸或浓硝酸
C . 浓硫酸和浓盐酸暴露在空气中浓度均逐渐减小
D . 氯化铵和碘都可以用加热法进行提纯
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
-
(1) 人体正常的血红蛋白含有Fe2+ , 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述错误的是______________(填字母)。A . 亚硝酸盐被还原 B . 维生素C是还原剂 C . 维生素C将Fe3+还原为Fe2+ D . 亚硝酸盐是还原剂
-
(2) 某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:。
-
(3) Fe与过量稀硫酸反应可以制取FeSO4 , 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是(填字母)。
a.Cl2 b.Fe c.H2O2 d.HNO3
-
(4) FeSO4可用于制备高铁酸钾(K2FeO4),写出在碱性条件下用 FeSO4 与NaClO反应制高铁酸钾的离子方程式: 。
①该反应中的还原剂是;②当有38g的FeSO4反应转移的电子数目为。
某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测得)如图所示。
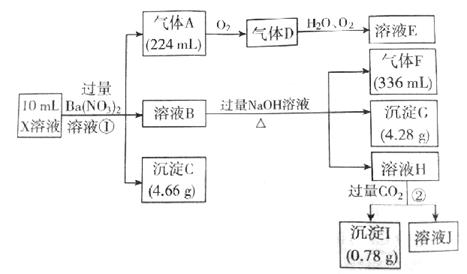
-
(1) 通过上述实验过程,一定不存在的离子是
-
(2) 反应①中生成A的离子方程式为:
-
(3) 若测得X溶液中C(H+)=5mol/L,则X溶液中(填“含”或“不含”)Fe3+ ,
C(Fe3+)=(若填不含,则不需要计算)mol/L,X溶液中 C(Cl-)=mol/L
关于硝酸的说法正确的是( )
A . 硝酸与金属反应时,主要是+5价的氮得电子
B . 浓硝酸与浓盐酸按3∶1的体积比混合,所得的混合物叫王水
C . 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
D . 常温下,向浓HNO3中投入 Fe片,会产生大量的红棕色气体
下列叙述错误的是( )
A . NH3 易液化,液氨常用作制冷剂
B . 与金属反应时,稀 HNO3 被还原为NO
C . 铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D . 稀 HNO3 和活泼金属反应时主要得到氢气
下列实验操作、实验现象和实验结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将少量浓硝酸分多次加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸的还原产物为NO2 |
| B | 将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2试样无法确定是否变质 |
| C | 2滴0.1mol·L−1 MgCl2溶液中滴加2ml 1mol·L−1 NaOH溶液,再滴加2滴0.1 mol·L−1 FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]> Ksp[Fe(OH)3] |
| D | 将溴乙烷和NaOH乙醇溶液混合加热,产生的气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
A . A
B . B
C . C
D . D
工业生产中用于储存浓硝酸的罐体,其制作材料可以是( )

A . 镁
B . 锌
C . 铁
D . 铜
下列由实验得出的结论正确的是( )
实验 | 结论 | |
A | 将金属钠在燃烧匙中点燃迅速伸入集满 |
|
B | 将打磨过的铝条放入试管,再加入 | 铝与浓硫酸常温下不反应 |
C | 将稀硝酸加入过量铁粉中,充分反应后再滴加 |
|
D | 向鸡蛋白溶液中加入饱和 | 蛋白质发生了变性 |
A . A
B . B
C . C
D . D
最近更新
 的集气瓶,产生大量的白烟,瓶内有黑色颗粒产生
的集气瓶,产生大量的白烟,瓶内有黑色颗粒产生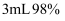 浓硫酸,铝条表面无明显现象
浓硫酸,铝条表面无明显现象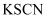 溶液,溶液不呈血红色
溶液,溶液不呈血红色 被稀硝酸氧化为
被稀硝酸氧化为
 溶液,有白色沉淀产生
溶液,有白色沉淀产生


