硝酸的化学性质 知识点题库
-
(1) 下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别 D. 用AgNO3和HNO3两种试剂来区别
-
(2) 人体正常的血红蛋白含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
-
(3) Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要求产物纯净,可选用的最佳试剂是 (填序号).
A.Cl2 B.Fe C.H2O2 D.HNO3
-
(4) 某同学把酸性高锰酸钾溶液滴入NaNO2溶液中,观察到紫色褪去,同时生成NO3﹣和Mn2+ , 请写出反应的离子方程式:
-
(5) 已知FeSO4在一定条件下可转变为高铁酸钾(K2FeO4),高铁酸钾是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体.高铁酸钾作为水处理剂发挥的作用是
-
(1) 配平: Zn+HNO3(很稀)═ Zn(NO3)2+NH4NO3+H2O
-
(2) 写出实验室制取NH3的化学方程式:
-
(3) 除去一氧化氮中的少量二氧化氮的最好方法(用方程式表示);
-
(4) 在含Cu+的酶(催化剂)的活化中心,亚硝酸根离子(NO
 )可转化为NO,写出Cu+在酸性水溶液中与NO
)可转化为NO,写出Cu+在酸性水溶液中与NO  反应的离子方程式:.
反应的离子方程式:.
亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。

查阅资料可知:
① 2NO+Na2O2  2NaNO2;2NO2+Na2O2
2NaNO2;2NO2+Na2O2  2NaNO3。
2NaNO3。
② NO能被酸性KMnO4氧化成  。
。
③ 在酸性条件下,NaNO2能将I−氧化为I2;  能将I2还原为I− ,即I2+2
能将I2还原为I− ,即I2+2 
 2I−+
2I−+  。
。
-
(1) 装置中仪器a的名称为,A中反应的化学方程式是。
-
(2) 装置B中观察到的主要现象是。
-
(3) 装置C中盛放的试剂是。
-
(4) 装置E的作用是。
-
(5) A中滴入浓硝酸之前,应先通入N2一段时间,原因是。
-
(6) 为测定所得NaNO2的纯度,准确称取m g NaNO2样品放入锥形瓶中并加入适量水溶解,再加入过量KI溶液并滴入几滴淀粉溶液,然后滴加稀硫酸,用cmol/L Na2S2O3溶液滴定至终点,重复操作2~3次,平均消耗Na2S2O3V mL。滴定终点的现象是。该样品中NaNO2的质量分数为。
 2CO+Si表明非金属性:碳>硅
B . 一定量的氯气与过量的铁粉在密闭容器中充分反应,有FeCl2生成
C . 将少量的浓硝酸滴入盛有过量的铜粉的试管中,气体产物只有NO2
D . 向新制备的饱和氯水中加入碳酸钙粉末可以增强氯水的漂白性
2CO+Si表明非金属性:碳>硅
B . 一定量的氯气与过量的铁粉在密闭容器中充分反应,有FeCl2生成
C . 将少量的浓硝酸滴入盛有过量的铜粉的试管中,气体产物只有NO2
D . 向新制备的饱和氯水中加入碳酸钙粉末可以增强氯水的漂白性

-
(1) 混合气体A的主要成分是。
-
(2) 气体B为,蓝色溶液D为。
-
(3) 单质M与浓硝酸反应的化学方程式是。
-
(4) 单质C与稀硝酸反应的化学方程式是。
-
(1) Ⅰ、蔗糖与浓硫酸的碳化实验会产生大量的有刺激性气味的气体,对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸(遇到CO变黑色)、滴有品红溶液的滤纸、滴有酸性高锰酸钾溶液的滤纸,a和b分别为两个小气球。
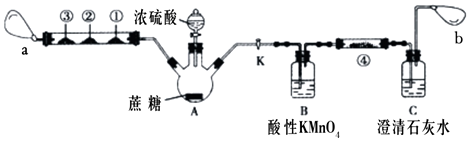
实验步骤如下:按图示连接好仪器,然后检查装置的气密性,装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
上图中盛有浓硫酸的仪器名称为。
-
(2) 根据实验中滤纸的现象说明SO2具有的性质分别是:②号;③号。
A.氧化性
B.还原性
C.漂白性
D.酸性氧化物通性
-
(3) B瓶中酸性高锰酸钾溶液的作用是,发生反应的离子方程式为。
-
(4) 打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2 , 为了证明有CO2生成并简化实验装置,可在④号装置放上滴有的滤纸。
A.品红溶液
B.酸性高锰酸钾
C.溴水
D.澄清石灰水
-
(5) Ⅱ、某化学课外活动小组对污染大气的部分非金属氧化物进行探究,请根据题目要求回答下列问题:
写出用硝酸制取NO的离子方程式。
-
(6) 查资料得知HCOOH
 CO+H2O,实验室有如图所示的装置,制取CO气体可选用的装置为(填序号),实验室利用该装置还可以制取的气体有(写一种气体的分子式)。
CO+H2O,实验室有如图所示的装置,制取CO气体可选用的装置为(填序号),实验室利用该装置还可以制取的气体有(写一种气体的分子式)。
-
(7) 查资料得知,利用催化剂可使汽车尾气中的CO和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持装置已略去)。
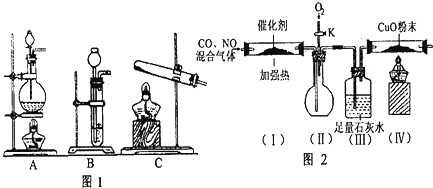
①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是。
②装置(Ⅲ)的主要作用是。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充装置。

①NH3易液化,液氨常用作制冷剂
②与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
③铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
④稀HNO3和活泼金属反应时主要得到氢气
 化学性质稳定,可作保护气
B .
化学性质稳定,可作保护气
B .  具有还原性,可作制冷剂
C .
具有还原性,可作制冷剂
C .  不与水反应,可氧化制得
不与水反应,可氧化制得 D . 浓
D . 浓 具有酸性,可钝化金属铝
具有酸性,可钝化金属铝




