硝酸的化学性质 知识点题库
一定量的铝铁合金与300mL 2mol/L的硝酸完全反应,生成3.36L NO(标准状况),三价铁盐和铝盐等,向反应后的溶液中加入3mol/L NaOH溶液恰好使Al3+、Fe3+完全反应并生成沉淀最多,则所加入NaOH溶液的体积是( )
A . 150mL
B . 300 mL
C . 450 mL
D . 600 mL
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛.”这里的“强水”是指( )
A . 氨水
B . 盐酸
C . 醋酸
D . 硝酸
浓硝酸保存在棕色瓶中的原因,写出化学方程式
亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害.其在酸性条件下会产生NO和NO2 . 下列有关说法错误的是( )
A . NaNO2既具有氧化性又具有还原性
B . 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C . NaNO2和胃酸作用的离子方程式为:2NO2﹣+2H+═NO↑+NO2↑+H2O
D . 1 mol NaNO2在酸性条件下完全反应生成NO和NO2 , 转移电子的物质的量为1 mol
下列物质易在空气中自燃的是( )
A . 氢气
B . 天然气
C . 酒精
D . 白磷
化学实验室中,为检验溶液中的Cl﹣ , 常向溶液中滴加稀硝酸和( )
A . Na+
B . Ag+
C . Ca2+
D . Ba2+
用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如右图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内液面上升,气体变成无色;③滴管内液面再次下降.下列说法中错误的是( )

A . 现象①中产生的红棕色气体为NO2
B . 产生现象②的原因是NO2与水反应
C . 产生现象③的原因是铜与稀硝酸反应
D . 最终瓶内溶液中的溶质只有Cu(NO3)2
在给定条件下,下列加线的物质在化学反应中几乎能被完全消耗的是( )
A . 8.7 g二氧化锰与50 mL8 mol•L﹣1浓盐酸共热制取氯气
B . 19.2 g铜与100 mL12 mol•L﹣1的硝酸反应
C . 常温下,将5.4 g铝片投入20 mL18 mol•L﹣1的硫酸中
D . 将足量的Cu置于50 mL18 mol•L﹣1H2SO4溶液中加热
下列描述正确的是( )
A . 实验室制取乙酸乙酯的方程式为:CH3COOH+H18O﹣C2H5 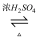 CH3COOC2H5+H
CH3COOC2H5+H  18O
B . 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+
C . 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D . 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
18O
B . 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+
C . 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D . 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
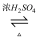 CH3COOC2H5+H
CH3COOC2H5+H  18O
B . 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+
C . 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D . 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
18O
B . 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+
C . 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D . 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
利用某废镍催化剂(含NiCO3、Na2SiO3 , 少量Fe3O4、Cr2O3)制备NiSO4 , 流程如下:

已知:①  的
的  分别是37.4、30.2/15.1/14.7,其中
分别是37.4、30.2/15.1/14.7,其中  。②
。②  与
与  性质类似。
性质类似。
-
(1) “酸溶”后,加入十六烷基三甲基氯化铵溶液出现大量白色沉淀,写出“酸溶”时生成硅酸的离子方程式:。
-
(2) “碱析”时,常温下调pH=时Fe3+恰好沉淀完全;工业上把pH调至10,此时沉淀物有Fe(OH)3和,目的是。
-
(3) 取300mL“除硅酸”后的溶液,加入双氧水受热,得到关于沉淀率的关系图如下。

①合适的工艺条件为;
②温度不能太高的原因是。
-
(4) “一次沉镍”产物为NiS,稀硝酸与之反应的化学反应方程式为。
某稀硫酸和稀硝酸的混合溶液
200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为
NO 气体),向另一份中逐渐加入铁粉,产生的气体 的量随铁粉质量增加的变化如图所示。

-
(1) AB 段的反应为
-
(2) 混合酸中NO3-物质的量为;H2SO4的浓度为
把铁与铜的混合物放入稀HNO3中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液里一定含有的金属盐是( )
A . Cu(NO3)2
B . Fe(NO3)3
C . Fe(NO3)2
D . Fe(NO3)2和Cu(NO3)2
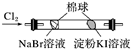
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 少量的Fe粉中加入足量稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸先变蓝后变白 | 浓氨水呈碱性且有漂白性 |
| D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
A . A
B . B
C . C
D . D
CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )
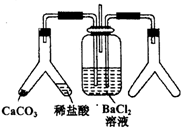
A . Cu和浓硝酸
B . CaO和浓氮水
C . Na2SO3和较浓硫酸
D . KMnO4溶液和浓盐酸
下列关于浓HNO3和浓H2SO4的叙述中正确的是( )
A . 常温下都不能用铝制容器贮存
B . 露置在空气中,容器内酸液的浓度都降低
C . 常温下都能与铜较快反应
D . 滴在紫色石蕊试纸上,试纸都只变红
下列关于硝酸性质的说法错误的是( )
A . 硝酸能与水易任意比互溶
B . 质量分数足够大时可形成发烟硝酸
C . 不易挥发,有刺激性气味
D . 浓硝酸因分解生成的二氧化氮又溶于硝酸而呈黄色
对下列有关事实的解释,其中错误的是( )
A . 常温下,浓硝酸可以用铝槽贮存,说明铝与浓硝酸不能反应
B . 浓硝酸在光照条件下其颜色变黄,说明浓硝酸不稳定见光容易分解
C . 在蔗糖固体中加入适量浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
D . 反应:CuSO+H2S=CuS↓+H2SO4能够进行,说明硫化铜既不溶于水,也不溶于稀硫酸
中华文化源远流长,对人类进步和社会发展有着巨大影响。《徐光启手记》中载有强水的制备方法:“绿矾  五斤,硝
五斤,硝  五斤。将矾炒去,(质量)约折五分之一。将二味同研细,用铁作锅,锅下起火……,开坛则药化为水,而锅亦坏矣。用水入五金皆成水,惟黄金不化水中,加盐(NaCl)则化……”。下列相关说法错误的是( )
五斤。将矾炒去,(质量)约折五分之一。将二味同研细,用铁作锅,锅下起火……,开坛则药化为水,而锅亦坏矣。用水入五金皆成水,惟黄金不化水中,加盐(NaCl)则化……”。下列相关说法错误的是( )
 五斤,硝
五斤,硝  五斤。将矾炒去,(质量)约折五分之一。将二味同研细,用铁作锅,锅下起火……,开坛则药化为水,而锅亦坏矣。用水入五金皆成水,惟黄金不化水中,加盐(NaCl)则化……”。下列相关说法错误的是( )
五斤。将矾炒去,(质量)约折五分之一。将二味同研细,用铁作锅,锅下起火……,开坛则药化为水,而锅亦坏矣。用水入五金皆成水,惟黄金不化水中,加盐(NaCl)则化……”。下列相关说法错误的是( )
A . “炒”矾时绿矾失去全部结晶水
B . 强水中加盐后形成王水能溶解金
C . 硝的焰色试验中火焰呈紫色
D . 制备强水过程中涉及氧化还原反应
中国传统文化博大精深,也蕴含着许多化学知识。下列说法正确的是( )
| A | 宋代烧制出“明如镜、声如磬”的瓷器 | 瓷器主要原料是SiO2 |
| B | 《梦溪笔谈》中“方家以磁石磨针锋,则能指南” | 磁石主要成分是Fe2O3 |
| C | 古代四大发明之一的火药“乃焰硝、硫磺、杉木炭所合” | 焰硝是指HNO3 |
| D | 《本草纲目》中记载石碱条:“彼人采蒿蓼之属,晒干烧灰,以水淋汁,……浣衣发面,亦去垢发面” | 石碱条主要成分是K2CO3 |
A . A
B . B
C . C
D . D
下列物质暴露在空气中质量会变轻的是( )
A . 氢氧化钠
B . 氯化钠
C . 浓硝酸
D . 浓硫酸
最近更新