з”»е…ғзҙ зҡ„еҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫ зҹҘиҜҶзӮ№
з”»е…ғзҙ зҡ„еҺҹеӯҗз»“жһ„зӨәж„Ҹеӣҫ зҹҘиҜҶзӮ№йўҳеә“
-
пјҲ1пјү з”»еҮәз ·зҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫпјҺ
-
пјҲ2пјү е·ҘдёҡдёҠеёёе°Ҷеҗ«з ·еәҹжёЈпјҲдё»иҰҒжҲҗеҲҶдёәAs2S3пјүеҲ¶жҲҗжөҶзҠ¶пјҢйҖҡе…ҘO2ж°§еҢ–пјҢз”ҹжҲҗH3AsO4е’ҢеҚ•иҙЁзЎ«пјҺеҶҷеҮәеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҺиҜҘеҸҚеә”йңҖиҰҒеңЁеҠ еҺӢдёӢиҝӣиЎҢпјҢеҺҹеӣ жҳҜпјҺ
-
пјҲ3пјү е·ІзҹҘпјҡAsпјҲsпјү+
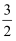 H2пјҲgпјү+2O2пјҲgпјү=H3AsO4пјҲsпјүв–іH1
H2пјҲgпјү+2O2пјҲgпјү=H3AsO4пјҲsпјүв–іH1H2пјҲgпјү+
 O2пјҲgпјү=H2OпјҲlпјүв–іH2
O2пјҲgпјү=H2OпјҲlпјүв–іH22AsпјҲsпјү+
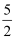 O2пјҲgпјү=As2O5пјҲsпјүв–іH3
O2пјҲgпјү=As2O5пјҲsпјүв–іH3еҲҷеҸҚеә”As2O5пјҲsпјү+3H2OпјҲlпјү=2H3AsO4пјҲsпјүзҡ„в–іH=пјҺ
-
пјҲ4пјү
298Kж—¶пјҢе°Ҷ20mL 3x molвҖўLп№Ј1 Na3AsO3гҖҒ20mL 3x molвҖўLп№Ј1 I2е’Ң20mL NaOHжә¶ж¶Іж··еҗҲпјҢеҸ‘з”ҹеҸҚеә”пјҡAsO33п№ЈпјҲaqпјү+I2пјҲaqпјү+2OHп№ЈвҮҢAsO43п№ЈпјҲaqпјү+2Iп№ЈпјҲaqпјү+H2OпјҲlпјүпјҺжә¶ж¶ІдёӯcпјҲAsO43п№ЈпјүдёҺеҸҚеә”ж—¶й—ҙпјҲtпјүзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҺ
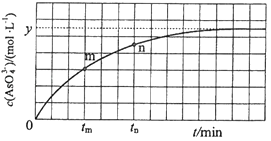
в‘ дёӢеҲ—еҸҜеҲӨж–ӯеҸҚеә”иҫҫеҲ°е№іиЎЎзҡ„жҳҜпјҲеЎ«ж ҮеҸ·пјүпјҺ
aпјҺжә¶ж¶Ізҡ„pHдёҚеҶҚеҸҳеҢ–
bпјҺvпјҲIп№Јпјү=2vпјҲAsO33п№Јпјү
cпјҺc пјҲAsO43п№Јпјү/c пјҲAsO33п№ЈпјүдёҚеҶҚеҸҳеҢ–
dпјҺcпјҲIп№Јпјү=y molвҖўLп№Ј1
в‘Ўtmж—¶пјҢvжӯЈ vйҖҶпјҲеЎ«вҖңеӨ§дәҺвҖқвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүпјҺ
в‘ўtmж—¶vйҖҶtnж—¶vйҖҶпјҲеЎ«вҖңеӨ§дәҺвҖқвҖңе°ҸдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјүпјҢзҗҶз”ұжҳҜпјҺ
в‘ЈиӢҘе№іиЎЎж—¶жә¶ж¶Ізҡ„pH=14пјҢеҲҷиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°KдёәпјҺ
иҜ·еӣһзӯ”дёҺиҝҷдёӨз§Қзү©иҙЁдёӯе…ғзҙ жңүе…ізҡ„дёҖдәӣй—®йўҳгҖӮ
-
пјҲ1пјү еҹәжҖҒй“ҒеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸдёәпјӣеҹәжҖҒй“ңеҺҹеӯҗзҡ„з”өеӯҗеҚ жҚ®зҡ„жңҖй«ҳиғҪеұӮз¬ҰеҸ·дёә гҖӮ
-
пјҲ2пјү ж°§е…ғзҙ зҡ„第дёҖз”өзҰ»иғҪе°ҸдәҺж°®е…ғзҙ пјҢе…¶еҺҹеӣ жҳҜ гҖӮ
-
пјҲ3пјү SO42-гҖҒH2OгҖҒNH4+дёүз§Қеҫ®зІ’дёӯпјҢз©әй—ҙжһ„еһӢдёәжӯЈеӣӣйқўдҪ“зҡ„жҳҜпјӣNH4+дёӯж°®еҺҹеӯҗзҡ„жқӮеҢ–иҪЁйҒ“зұ»еһӢжҳҜгҖӮ
-
пјҲ4пјү еҶҷеҮәдёҺSO42-дә’дёәзӯүз”өеӯҗдҪ“зҡ„еҲҶеӯҗзҡ„еҢ–еӯҰејҸ (еҶҷдёҖз§Қ)гҖӮ
-
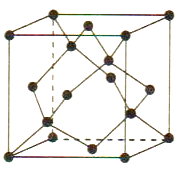
пјҲ5пјү CuдёҺAuзҡ„еҗҲйҮ‘еҸҜеҪўжҲҗйқўеҝғз«Ӣж–№жңҖеҜҶе Ҷз§Ҝзҡ„жҷ¶дҪ“пјҢеңЁиҜҘжҷ¶иғһдёӯCu еҺҹеӯҗеӨ„дәҺйқўеҝғпјҢиҜҘжҷ¶дҪ“е…·жңүеӮЁж°ўеҠҹиғҪпјҢж°ўеҺҹеӯҗеҸҜиҝӣе…ҘеҲ°CuеҺҹеӯҗдёҺAuеҺҹеӯҗжһ„жҲҗзҡ„з«Ӣж–№дҪ“з©әйҡҷдёӯпјҢеӮЁж°ўеҗҺзҡ„жҷ¶иғһз»“жһ„дёҺйҮ‘еҲҡзҹіжҷ¶иғһз»“жһ„(еҰӮеӣҫ) зӣёдјјпјҢиҜҘжҷ¶дҪ“еӮЁж°ўеҗҺзҡ„еҢ–еӯҰејҸдёәпјҢиӢҘиҜҘжҷ¶дҪ“зҡ„еҜҶеәҰдёәПҒg.cm-3 пјҢ еҲҷжҷ¶иғһдёӯCuеҺҹеӯҗдёҺAuеҺҹеӯҗдёӯеҝғзҡ„жңҖзҹӯи·қзҰ»d=cm (NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖј)гҖӮ
-
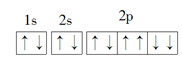
пјҲ1пјү зҺ°д»ЈеҢ–еӯҰдёӯпјҢеёёеҲ©з”ЁдёҠзҡ„зү№еҫҒи°ұзәҝжқҘйүҙе®ҡе…ғзҙ гҖӮGaзҡ„еӨ–еӣҙз”өеӯҗжҺ’еёғејҸдёәпјҡпјҢеҹәжҖҒGaеҺҹеӯҗж ёеӨ–жңүз§ҚиҝҗеҠЁзҠ¶жҖҒдёҚеҗҢзҡ„з”өеӯҗгҖӮ
-
пјҲ2пјү й”—гҖҒз ·гҖҒзЎ’гҖҒжәҙзҡ„第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјҲз”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨәпјүпјӣе…¶дёӯй”—зҡ„еҢ–еҗҲзү©еӣӣж°ҜеҢ–й”—еҸҜз”ЁдҪңе…үеҜјзәӨз»ҙжҺәжқӮеүӮпјҢе…¶зҶ”зӮ№дёә-49.5в„ғпјҢжІёзӮ№дёә83.1в„ғпјҢеҲҷе…¶жҷ¶дҪ“зұ»еһӢдёәпјҢдёӯеҝғеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢдёәпјӣз ·й…ёзҡ„й…ёжҖ§ејұдәҺзЎ’й…ёпјҢд»ҺеҲҶеӯҗз»“жһ„зҡ„и§’еәҰи§ЈйҮҠеҺҹеӣ гҖӮ
-
пјҲ3пјү й“ҒиғҪеҪўжҲҗ[Fe(Bipy)2Cl2]ClO4зӯүеӨҡз§Қй…ҚеҗҲзү©пјҲBipyз»“жһ„еҰӮдёӢеӣҫAпјүгҖӮ
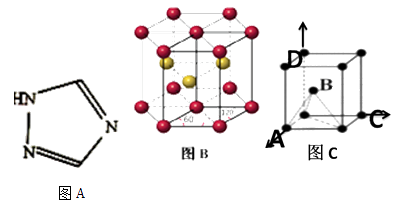
в‘ иҜҘй…ҚеҗҲзү©дёӯдёӯеҝғеҺҹеӯҗзҡ„еҢ–еҗҲд»·дёәпјӣдёҺдёӯеҝғеҺҹеӯҗеҪўжҲҗй…ҚдҪҚй”®зҡ„еҺҹеӯҗжҳҜгҖӮ
в‘ЎдёҺClO4-дә’дёәзӯүз”өеӯҗдҪ“зҡ„дёҖз§ҚйқһжһҒжҖ§еҲҶеӯҗжҳҜ(дёҫ1дҫӢ)гҖӮ
в‘ў1 mol BipyдёӯжүҖеҗ«Пғй”®molгҖӮ
-
пјҲ4пјү й’ӣпјҲTiпјүиў«иӘүдёәвҖң21дё–зәӘйҮ‘еұһвҖқпјҢTiжҷ¶дҪ“зҡ„е Ҷз§Ҝж–№ејҸжҳҜе…ӯж–№жңҖеҜҶе Ҷз§ҜеҰӮеӣҫBжүҖзӨәпјҢжҷ¶иғһеҸҜз”ЁеӣҫCиЎЁзӨәгҖӮи®ҫйҮ‘еұһTiзҡ„еҺҹеӯҗеҚҠеҫ„дёәa cmпјҢз©әй—ҙеҲ©з”ЁзҺҮдёәгҖӮи®ҫжҷ¶иғһдёӯAзӮ№еҺҹеӯҗзҡ„еқҗж ҮдёәпјҲ1пјҢ0пјҢ0пјүпјҢCзӮ№еҺҹеӯҗзҡ„еқҗж ҮдёәпјҲ0пјҢ1пјҢ0пјүпјҢDзӮ№еҺҹеӯҗзҡ„еқҗж ҮдёәпјҲ0пјҢ0пјҢ1пјүпјҢеҲҷBзӮ№еҺҹеӯҗзҡ„еқҗж ҮдёәгҖӮ
 C .
C . 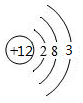 D .
D . 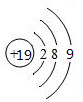
-
пјҲ1пјү зҺ°жңүдёӢеҲ—еҚҒз§Қзү©иҙЁпјҡв‘ H2OгҖҒв‘Ў з©әж°”гҖҒв‘ў MgгҖҒв‘Ј H2SO4гҖҒв‘Ө CaOгҖҒв‘Ҙ CuSO4гҖҒв‘Ұ зўҳй…’гҖҒ⑧ Ca(OH)2гҖҒв‘Ё й…’зІҫгҖҒв‘© NaHCO3 пјҢ е…¶дёӯеұһдәҺж··еҗҲзү©зҡ„жҳҜ(еЎ«еәҸеҸ·пјҢдёӢеҗҢ)пјҢеұһдәҺж°§еҢ–зү©зҡ„жҳҜпјҢеұһдәҺй…ёзҡ„жҳҜпјҢеұһдәҺзўұзҡ„жҳҜпјҢеұһдәҺзӣҗзҡ„жҳҜгҖӮ
-
пјҲ2пјү з”ЁеҢ–еӯҰз”ЁиҜӯеЎ«з©әпјҡ
ж°ҜеҺҹеӯҗзҡ„з»“жһ„зӨәж„ҸеӣҫпјӣNa2O2дёӯж°§е…ғзҙ зҡ„еҢ–еҗҲд»·дёәпјӣ5дёӘзЈ·й…ёж №зҰ»еӯҗпјӣ
-
пјҲ3пјү NH4+зҡ„ж‘©е°”иҙЁйҮҸдёәгҖӮ
-
пјҲ1пјү AпјҢBпјҢCпјҢD зҡ„е…ғзҙ з¬ҰеҸ·еҲҶеҲ«дёәгҖҒгҖҒгҖҒгҖӮ
-
пјҲ2пјү B2вҲ’зҡ„з”өеӯҗејҸдёәпјҢD еҺҹеӯҗзҡ„з»“жһ„зӨәж„ҸеӣҫдёәпјҢBдёҺCеҪўжҲҗзҡ„з®ҖеҚ•еҢ–еҗҲзү©зҡ„з”өеӯҗејҸдёәгҖӮ
 D . ж ҮеҮҶзҠ¶еҶөдёӢеҜҶеәҰдёә1.25g/Lзҡ„ж°”жҖҒзғғзҡ„зҗғжЈҚжЁЎеһӢпјҡ
D . ж ҮеҮҶзҠ¶еҶөдёӢеҜҶеәҰдёә1.25g/Lзҡ„ж°”жҖҒзғғзҡ„зҗғжЈҚжЁЎеһӢпјҡ 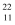 Na
B . ж°ҜеҺҹеӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
Na
B . ж°ҜеҺҹеӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ  C . NaCNзҡ„з”өеӯҗејҸпјҡ
C . NaCNзҡ„з”өеӯҗејҸпјҡ 

![]()
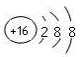 B .
B .  D . 2311Na+
D . 2311Na+
|
е…ғзҙ зј–еҸ· |
е…ғзҙ жҖ§иҙЁдёҺеҺҹеӯҗ(жҲ–еҲҶеӯҗ)з»“жһ„ |
|
T |
жңҖеӨ–еұӮз”өеӯҗж•°жҳҜж¬ЎеӨ–еұӮз”өеӯҗж•°зҡ„3еҖҚ |
|
X |
еёёжё©дёӢеҚ•иҙЁеҲҶеӯҗдёәеҸҢеҺҹеӯҗеҲҶеӯҗпјҢ еҲҶеӯҗдёӯеҗ«жңү3еҜ№е…ұз”Ёз”өеӯҗеҜ№ |
|
Y |
MеұӮжҜ”KеұӮе°‘1дёӘз”өеӯҗ |
|
Z |
第дёүе‘Ёжңҹе…ғзҙ зҡ„йҮ‘еұһзҰ»еӯҗдёӯеҚҠеҫ„жңҖе°Ҹ |
-
пјҲ1пјү еҶҷеҮәе…ғзҙ Tзҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫпјҡгҖӮ
-
пјҲ2пјү е…ғзҙ YдёҺе…ғзҙ ZзӣёжҜ”пјҢйҮ‘еұһжҖ§иҫғејәзҡ„жҳҜ(з”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨә)пјҢдёӢеҲ—иЎЁиҝ°дёӯиғҪиҜҒжҳҺиҝҷдёҖдәӢе®һзҡ„жҳҜ(еЎ«еӯ—жҜҚ)гҖӮ
aпјҺYеҚ•иҙЁзҡ„зҶ”зӮ№жҜ”ZеҚ•иҙЁдҪҺ
bпјҺYзҡ„еҢ–еҗҲд»·жҜ”ZдҪҺ
cпјҺYеҚ•иҙЁдёҺж°ҙеҸҚеә”жҜ”ZеҚ•иҙЁдёҺж°ҙеҸҚеә”еү§зғҲ
dпјҺYжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©зҡ„зўұжҖ§жҜ”Zзҡ„ејә
-
пјҲ3пјү TгҖҒXгҖҒYгҖҒZдёӯжңүдёӨз§Қе…ғзҙ иғҪеҪўжҲҗж—ўжңүзҰ»еӯҗй”®еҸҲжңүйқһжһҒжҖ§е…ұд»·й”®зҡ„еҢ–еҗҲзү©пјҢеҶҷеҮәиҜҘеҢ–еҗҲзү©зҡ„з”өеӯҗејҸпјҡгҖӮ
-
пјҲ4пјү е…ғзҙ Tе’Ңж°ўе…ғзҙ д»ҘеҺҹеӯҗдёӘж•°жҜ”дёә1вҲ¶1еҢ–еҗҲеҪўжҲҗеҢ–еҗҲзү©QпјҢе…ғзҙ XдёҺж°ўе…ғзҙ д»ҘеҺҹеӯҗдёӘж•°жҜ”1вҲ¶2еҢ–еҗҲеҪўжҲҗеёёз”ЁдәҺзҒ«з®ӯзҮғж–ҷзҡ„еҢ–еҗҲзү©WпјҢQдёҺWеҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢз”ҹжҲҗXеҚ•иҙЁе’ҢTзҡ„еҸҰдёҖз§Қж°ўеҢ–зү©пјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ гҖӮ
 B . Na+зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
B . Na+зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ |
X |
LеұӮз”өеӯҗж•°жҳҜKеұӮз”өеӯҗж•°зҡ„3еҖҚ |
|
Y |
ж ёеӨ–з”өеӯҗеұӮж•°зӯүдәҺеҺҹеӯҗеәҸж•° |
|
Z |
LеұӮз”өеӯҗж•°жҳҜKеұӮе’ҢMеұӮз”өеӯҗж•°д№Ӣе’Ң |
|
W |
жңҖеӨ–еұӮз”өеӯҗж•°жҳҜж¬ЎеӨ–еұӮз”өеӯҗж•°зҡ„2.5еҖҚ |
-
пјҲ1пјү еҶҷеҮәWзҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫпјҡгҖӮ
-
пјҲ2пјү е…ғзҙ XдёҺе…ғзҙ ZзӣёжҜ”пјҢйқһйҮ‘еұһжҖ§иҫғејәзҡ„жҳҜ(еЎ«е…ғзҙ еҗҚз§°)пјҢеҶҷеҮәдёҖдёӘиғҪиЎЁзӨәXгҖҒZйқһйҮ‘еұһжҖ§ејәејұе…ізі»зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡгҖӮ
-
пјҲ3пјү XгҖҒYгҖҒZгҖҒWеӣӣз§Қе…ғзҙ еҪўжҲҗзҡ„дёҖз§ҚзҰ»еӯҗеҢ–еҗҲзү©пјҢе…¶ж°ҙжә¶ж¶Іжҳҫејәй…ёжҖ§пјҢиҜҘеҢ–еҗҲзү©зҡ„еҢ–еӯҰејҸдёәгҖӮ
-
пјҲ4пјү е…ғзҙ Xе’Ңе…ғзҙ Yд»ҘеҺҹеӯҗдёӘж•°д№ӢжҜ”1вҲ¶1еҢ–еҗҲеҪўжҲҗеҢ–еҗҲзү©QпјҢе…ғзҙ Wе’Ңе…ғзҙ YеҢ–еҗҲеҪўжҲҗеҢ–еҗҲзү©MпјҢQе’ҢMзҡ„з”өеӯҗжҖ»ж•°зӣёзӯүгҖӮд»ҘMдёәзҮғж–ҷпјҢQдёәж°§еҢ–еүӮпјҢеҸҜдҪңзҒ«з®ӯжҺЁиҝӣеүӮпјҢжңҖз»Ҳз”ҹжҲҗж— жҜ’дё”еңЁиҮӘ然з•ҢдёӯзЁіе®ҡеӯҳеңЁзҡ„зү©иҙЁпјҢMзҡ„з»“жһ„ејҸдёәпјҢеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ
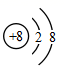 гҖҒ
гҖҒ 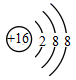 гҖҒ
гҖҒ 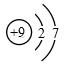 B .
B .  C .
C . 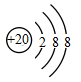 D .
D . 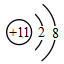


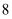 зҡ„
зҡ„ 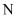 еҺҹеӯҗпјҡ
еҺҹеӯҗпјҡ  B .
B . 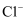 зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ 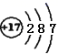 C .
C .  зҡ„з”өеӯҗејҸпјҡ
зҡ„з”өеӯҗејҸпјҡ |
ж—Ҹ е‘Ёжңҹ |
в… A |
в…ЎA |
в…ўA |
в…ЈA |
в…ӨA |
в…ҘA |
в…ҰA |
0 |
|
1 |
в‘ |
|||||||
|
2 |
в‘Ў |
в‘ў |
в‘Ј |
|||||
|
3 |
в‘Ө |
в‘Ҙ |
в‘Ұ |
⑧ |
в‘Ё |
в‘© |
||
|
4 |
-
пјҲ1пјү иҜ·з”»еҮәе…ғзҙ в‘ЁйҳҙзҰ»еӯҗзҡ„з»“жһ„зӨәж„ҸеӣҫпјҡгҖӮ
-
пјҲ2пјү в‘Ўв‘Ҙв‘Ұзҡ„еҺҹеӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ3пјү в‘ -в‘ЁеҸ·е…ғзҙ дёӯе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯй…ёжҖ§жңҖејәзҡ„жҳҜпјҢзўұжҖ§жңҖејәзҡ„жҳҜпјҢв‘ў гҖҒ⑧дёӨз§Қе…ғзҙ зҡ„жңҖз®ҖеҚ•ж°ўеҢ–зү©зҡ„зҶ”зӮ№иҫғй«ҳзҡ„жҳҜпјҲеқҮз”ЁеҢ–еӯҰејҸиЎЁзӨәпјүгҖӮ
-
пјҲ4пјү в‘ўв‘ӨдёӨз§Қе…ғзҙ зҡ„еҺҹеӯҗжҢү1пјҡ1з»„жҲҗзҡ„еёёи§ҒеҢ–еҗҲзү©зҡ„з”өеӯҗејҸдёәпјӣе…ғзҙ в‘Өзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©дёӯеҗ«жңүзҡ„еҢ–еӯҰй”®зұ»еһӢдёәгҖӮ
-
пјҲ5пјү ж¬ІжҜ”иҫғв‘ўе’Ң⑧дёӨз§Қе…ғзҙ зҡ„йқһйҮ‘еұһжҖ§ејәејұпјҢеҸҜд»ҘдҪңдёәйӘҢиҜҒзҡ„иҜҒжҚ®жҳҜпјҲеЎ«еӯ—жҜҚпјүгҖӮ
A жҜ”иҫғиҝҷдёӨз§Қе…ғзҙ еҚ•иҙЁзҡ„жІёзӮ№
B жҜ”иҫғиҝҷдёӨз§Қе…ғзҙ еҚ•иҙЁдёҺж°ўж°”еҢ–еҗҲзҡ„йҡҫжҳ“
C жҜ”иҫғиҝҷдёӨз§Қе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§
-
пјҲ6пјү в‘ЁеҚ•иҙЁдёҺж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮ
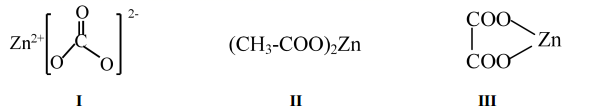
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү Znдёә30еҸ·е…ғзҙ пјҢе®ғеңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜгҖӮ
-
пјҲ2пјү еҺҹж–ҷв… дёӯйҳҙзҰ»еӯҗз©әй—ҙз»“жһ„дёәпјҢе…¶зӯүз”өеӯҗдҪ“дёә(еҶҷеҮә1з§ҚеҚіеҸҜ)гҖӮ
-
пјҲ3пјү еҺҹж–ҷв…ЎгҖҒв…ўйҳҙзҰ»еӯҗеҜ№еә”зҡ„й…ёжІёзӮ№иҫғй«ҳзҡ„жҳҜ(еҶҷз»“жһ„з®ҖејҸ)пјҢеҺҹеӣ жҳҜгҖӮ
-
пјҲ4пјү е…ідәҺд»ҘдёҠеҮ з§Қй”ҢзӣҗиҜҙжі•жӯЈзЎ®зҡ„жҳҜ____гҖӮA . еҢ–еҗҲзү©в…Ўдёӯз”өиҙҹжҖ§жңҖеӨ§зҡ„е…ғзҙ жҳҜO B . еҢ–еҗҲзү©в…ЎдёӯжүҖжңүCеҺҹеӯҗзҡ„жқӮеҢ–еҪўејҸеқҮдёәsp3 C . еҢ–еҗҲзү©в…ўдёӯеҸӘеӯҳеңЁзҰ»еӯҗй”®е’ҢжһҒжҖ§е…ұд»·й”® D . еҢ–еҗҲзү©в… йҳҙзҰ»еӯҗдёӯПғй”®е’ҢПҖй”®ж•°зӣ®жҜ”дёә2пјҡ1
-
пјҲ5пјү ZnOеӯҳеңЁеӨҡз§Қжҷ¶дҪ“з»“жһ„пјҢе…¶дёӯзәӨй”ҢзҹҝеһӢе’Ңй—Әй”ҢзҹҝеһӢжҳҜжңҖеёёи§Ғзҡ„жҷ¶дҪ“з»“жһ„пјҢдёӢеӣҫдёәиҝҷдёӨз§Қжҷ¶дҪ“зҡ„еұҖйғЁз»“жһ„гҖӮ

в‘ еӣҫaдёҚжҳҜзәӨй”ҢзҹҝеһӢZnOзҡ„жҷ¶иғһеҚ•е…ғпјҢеҺҹеӣ жҳҜгҖӮ
в‘Ўеӣҫbй—Әй”ҢзҹҝеһӢеұһдәҺз«Ӣж–№жҷ¶иғһпјҢеҺҹеӯҗ1зҡ„еқҗж Үдёә
 пјҢ еҲҷеҺҹеӯҗ2зҡ„еқҗж ҮдёәгҖӮ
пјҢ еҲҷеҺҹеӯҗ2зҡ„еқҗж ҮдёәгҖӮв‘ўеӣҫ
 зҡ„й—Әй”ҢзҹҝеһӢZnOжҷ¶дҪ“дёӯзҰ»Oи·қзҰ»жңҖиҝ‘зҡ„ZnеҺҹеӯҗж•°дёәпјҢе…¶жҷ¶иғһеҸӮж•°дёәa nmпјҢйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёәNA пјҢ еҲҷжҷ¶дҪ“еҜҶеәҰдёәg/cm3(еҲ—еҮәи®Ўз®—ејҸ)гҖӮ
зҡ„й—Әй”ҢзҹҝеһӢZnOжҷ¶дҪ“дёӯзҰ»Oи·қзҰ»жңҖиҝ‘зҡ„ZnеҺҹеӯҗж•°дёәпјҢе…¶жҷ¶иғһеҸӮж•°дёәa nmпјҢйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёәNA пјҢ еҲҷжҷ¶дҪ“еҜҶеәҰдёәg/cm3(еҲ—еҮәи®Ўз®—ејҸ)гҖӮ
ж—Ҹ е‘Ёжңҹ | в… A | в…ЎA | в…ўA | в…ЈA | в…ӨA | в…ҘA | в…ҰA | 0 |
дёҖ | в‘ | |||||||
дәҢ | в‘Ў | в‘ў | в‘Ј | в‘Ө | ||||
дёү | в‘Ҙ | в‘Ұ | ⑧ | в‘Ё | ||||
еӣӣ | в‘© | |||||||
-
пјҲ1пјү иЎЁдёӯе…ғзҙ ⑧зҡ„еҺҹеӯҗз»“жһ„зӨәж„ҸеӣҫдёәпјҢв‘ ~в‘©е…ғзҙ дёӯпјҢжңҖдёҚжҙ»жіјзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ еҗҚз§°пјүгҖӮ
-
пјҲ2пјү в‘ ~в‘©е…ғзҙ дёӯпјҢйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјҢеҺҹеӯҗеҚҠеҫ„жңҖе°Ҹзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјӣжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©й…ёжҖ§жңҖејәзҡ„жҳҜпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ
-
пјҲ3пјү иЎЁдёӯ④⑧⑨е…ғзҙ зҡ„ж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸдёәпјҲеЎ«еҢ–еӯҰејҸпјүпјӣеҶҷеҮәе…ғзҙ в‘Ўзҡ„ж°ўеҢ–зү©зҡ„з”өеӯҗејҸгҖӮ
-
пјҲ4пјү иЎЁдёӯе…ғзҙ в‘ўдёҺе…ғзҙ в‘ҰеҪўжҲҗзҡ„зү©иҙЁжҳҜпјҲеЎ«еҢ–еӯҰејҸпјүпјҢеҶҷеҮәиҜҘзү©иҙЁдёҺв‘Ҙзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјӣеҶҷеҮәиҜҘзү©иҙЁдёҺзӣҗй…ёеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
 е’Ң
е’Ң B .
B .  е’Ң
е’Ң C .
C .  е’Ң
е’Ң D .
D .  е’Ң
е’Ң



