画元素的原子结构示意图 知识点题库
下列各项表述中正确的是( )
A . Na2O中的Na+和O2-的核外电子排布不相同
B . 106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)
C . 在氮原子中,质子数为7而中子数不一定为7
D . Cl-的结构示意图为 

前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是( )
A . A的离子结构示意图为 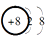 B . D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C . E和D形成的离子化合物ED2的电子式为
B . D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
C . E和D形成的离子化合物ED2的电子式为  D . B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
D . B的氧化物为离子化合物,只含离子键,其晶体为离子晶体
四种短周期元素的性质或结构信息如下表所示。请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质或结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 其单质为双原子分子,分子中含有3对共用电子对,常温下其气体单质性质稳定,但其原子较活泼 | 其单质质软,是银白色固体,导电性强。单质在空气中燃烧发出黄色火焰 | 第三周期元素的简单离子中半径最小 |
-
(1) 写出元素T的离子结构示意图: ;写出元素X的气态氢化物的电子式:;写出Z元素原子的核外电子排布式:;元素Y的原子核外共有种形状不同的电子云。
-
(2) Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式:。
-
(3) 元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a.常温下氟气的颜色比T单质的深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素显正价
d.比较两元素的单质与氢气化合时得电子的数目
下列表示正确的是( )
A . S2﹣离子的结构示意图:  B . H,D,T表示同一种核素
C . H2O2中氧元素的化合价为﹣2价
D . H2SO4的摩尔质量是98g
B . H,D,T表示同一种核素
C . H2O2中氧元素的化合价为﹣2价
D . H2SO4的摩尔质量是98g
下列有关化学用语表示正确的是( )
A . 中子数为1的氢原子: 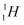 B . 硫原子的结构示意图:
B . 硫原子的结构示意图:  C . N2的电子式:
C . N2的电子式:  D . 乙醇的结构简式:C2H5OH
D . 乙醇的结构简式:C2H5OH
 B . 硫原子的结构示意图:
B . 硫原子的结构示意图:
位于3个不同短周期的主族元素a、b、c、d、e,原子序数依次增大,其中b、d同主族,d元素最高化合价与最低化合价代数和等于4,c原子最外层电子数比b原子次外层电子数多1,回答下列问题。
-
(1) 写出a的元素符号,b在周期表中的位置是第周期族;
-
(2) a与e形成的是(填“离子”或“共价”)化合物;
-
(3) 上述五种元素中,非金属性最强的是(填元素名称);
-
(4) d元素最高价氧化物对应水化物的化学式是,d和e的气态氢化物稳定性强的是(填化学式);
-
(5) 元素c的原子结构示意图为;c的单质与a的同主族第3周期元素最高价氧化物对应水化物反应的离子方程式为。
有如下三种微粒的结构示意图,下列说法正确的是( )
①  ②
②  ③
③ 
A . ①②是同种元素的微粒,且①是阴离子,②是原子
B . ①②是同种元素的微粒,且①是原子,②是阳离子
C . ②③是同种元素的原子
D . ①②属于同种元素的原子
以下表示氦原子结构的化学用语中,对电子运动状态描述最详细的是( )
A . 1s2
B .  C . :He
D .
C . :He
D . 
下列化学用语的书写,正确的是( )
A . 氯原子的结构示意图: 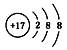 B . 6个质子8个中子的碳元素的核素符号:12C
C . 氯化镁的电子式:[
B . 6个质子8个中子的碳元素的核素符号:12C
C . 氯化镁的电子式:[ 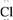 ]-Mg2+[
]-Mg2+[ 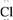 ]-
D . 用电子式表示氯化氢的形成过程:H·+·
]-
D . 用电子式表示氯化氢的形成过程:H·+· 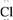 ―→H+[
―→H+[ 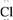 ]-
]-
 B . 6个质子8个中子的碳元素的核素符号:12C
C . 氯化镁的电子式:[
B . 6个质子8个中子的碳元素的核素符号:12C
C . 氯化镁的电子式:[
下列有关化学用语的表达错误的是( )
A . 次氯酸的电子式:  B . CCl4分子的比例模型:
B . CCl4分子的比例模型:  C . 硫离子的结构示意图:
C . 硫离子的结构示意图: 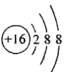 D . 过氧化钠的形成过程:
D . 过氧化钠的形成过程: 
 D . 过氧化钠的形成过程:
D . 过氧化钠的形成过程:
最近科学家发现使用钾和铜的微小尖峰可将二氧化碳和水转变为乙醇。下列有关化学用语表示正确的是( )
A . 二氧化碳的比例模型:  B . 中子数为34,质子数为29的铜原子:
B . 中子数为34,质子数为29的铜原子:  C . 钾原子的结构示意图:
C . 钾原子的结构示意图: 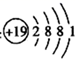 D . 乙醇的结构简式:CH3OCH3
D . 乙醇的结构简式:CH3OCH3
 C . 钾原子的结构示意图:
C . 钾原子的结构示意图:  D . 乙醇的结构简式:CH3OCH3
D . 乙醇的结构简式:CH3OCH3
NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如图:

部分金属氢氧化物Ksp近似值如下表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
-
(1) Al的原子结构示意图为。
-
(2) “酸浸”、“溶解”所使用的酸为。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、。
-
(3) “氧化”加入H2O2溶液,其作用是(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为。
-
(4) “操作①”的实验操作依次为缓缓加热,浓缩至为止、冷却结晶、过滤、洗涤、干燥,即得产品。
-
(5) 镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2
 MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式。
-
(1) 处于下列状态的物质中:①氯化钠晶体 ②干冰 ③HCl气体 ④铜 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔融的硝酸钾 ⑨NaCl溶液
能导电的是(填标号,下同);
属于电解质的是;
属于非电解质的是;
-
(2) 在一定条件下,RO
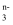 和I-可以发生反应,离子方程式为RO
和I-可以发生反应,离子方程式为RO 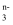 +6I-+6H+=R-+3I2+3H2O根据计算回答:
+6I-+6H+=R-+3I2+3H2O根据计算回答: ①RO
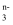 中n值为;
中n值为;②RO
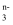 中元素R的化合价为。
中元素R的化合价为。③若R为氯元素,写出R的原子结构示意图
-
(3) 写出下列物质的电离方程式
H2SO4 :,
NaHCO3 :
KOH:
元素周期表是安置元素的一座“大厦”,已知原子的下列结构或性质,能确定其在周期表中的“单元号和房间号”即位置的是( )
A . 某元素原子的第二电子层电子轨道表示式为  B . 某元素在某种化合物中的化合价为+4
C . 某元素的原子最外层上电子数为6
D . 某元素的原子外围电子排布式为5s25p1
B . 某元素在某种化合物中的化合价为+4
C . 某元素的原子最外层上电子数为6
D . 某元素的原子外围电子排布式为5s25p1
下列原子结构模型的排序符合历史发展顺序的是( )
①实心球模型②卢瑟福核式模型
③葡萄干布丁模型④电子云模型
A . ①③②④
B . ①②③④
C . ①④③②
D . ①③④②
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y是短周期元素中原子半径最大的元素,Z是一种金属元素,其单质与稀盐酸或氢氧化钠溶液都能反应生成氢气,Z与W最外层电子数之和等于10。根据题目信息回答下列问题。
-
(1) X的原子结构示意图为:。
-
(2) 由X和Y两种元素组成的化合物有和两种(填化学式),其中常用作呼吸面具的供氧剂的这种化合物的电子式是:。
-
(3) Z的单质与稀盐酸反应的离子方程式:。
-
(4) 常温下,W的单质是一种色的气体,实验室制取该气体的化学反应方程式为:。
短周期主族元素X、Y、Z、W的原子序数依次增大,Z可与X形成淡黄色固体化合物G;X与W可形成化合物W2X,该化合物溶于水可生成具有漂白性的物质;Y、W的最外层电子数相同。请回答下列问题:
-
(1) X的元素符号为;Y的原子结构示意图为。
-
(2) G中含有的化学键类型有;用电子式表示G的形成过程:。
-
(3) W2X的结构式为,其溶于水发生反应的化学方程式为。
下列化学用语或图示表达正确的是( )
A .  的电子式
的电子式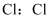 B .
B .  的
的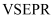 模型
模型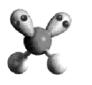 C .
C . 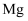 的原子结构示意图
的原子结构示意图 D . 苯的分子结构模型
D . 苯的分子结构模型
 的电子式
的电子式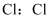 B .
B .  的
的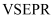 模型
模型 C .
C . 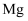 的原子结构示意图
的原子结构示意图 D . 苯的分子结构模型
D . 苯的分子结构模型
下列对化学用语的描述中,错误的是( )
A . 硫离子的结构示意图: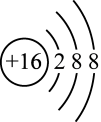 B .
B . 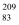 Bi和
Bi和 Bi互为同位素
C . 由H和Cl形成HCl的过程:
Bi互为同位素
C . 由H和Cl形成HCl的过程: D . 由Na和Cl形成NaCl的过程:
D . 由Na和Cl形成NaCl的过程:
 B .
B . 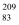 Bi和
Bi和 Bi互为同位素
C . 由H和Cl形成HCl的过程:
Bi互为同位素
C . 由H和Cl形成HCl的过程:
对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A . 原子核外电子排布式:M为1s22s2 , N为1s2
B . 结构示意图:M为 ,N为
,N为 C . M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D . M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
C . M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D . M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
 ,N为
,N为 C . M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D . M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
C . M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D . M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
最近更新



