以氯碱工业为基础的化工生产简介 知识点
以氯碱工业为基础的化工生产简介 知识点题库
-
(1)
实验一 制取氯酸钾和氯水
利用右图所示的实验装置进行实验。
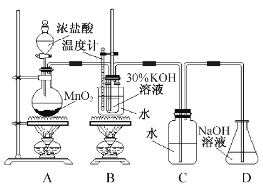
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有 。
(2)若对调B和C装置的位置, (填“能”或 “不能”)提高B中氯酸钾的产率。
-
(2) 实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3 。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号
1
2
3
4
0.20mol/LKI/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0.10
0.10
0.10
0.10
6.0mol/LH2SO4/mL
0
3.0
6.0
9.0
蒸馏水
9.0
6.0
3.0
0
实验现象
①系列a实验的实验目的是 。
②设计1号试管实验的作用是 。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为 。
-
(3)
实验三 测定饱和氯水中氯元素的总量
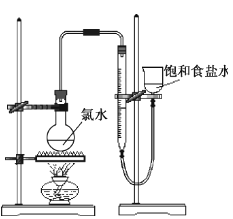
(4)该小组设计的实验方案为:使用右图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是。
(不考虑实验装置及操作失误导致不可行的原因)
-
(4) 根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
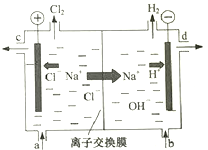
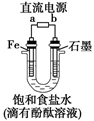
(1)写出电解饱和食盐水的离子方程式 .
(2)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出.(选填“a”、“b”、“c”或“d”)
(3)室温下,0.1mol/L次氯酸钠溶液的pH 0.1mol/L亚硫酸钠溶液的pH.(选填“大于”、“小于”、“等于”)浓度均为0.1mol/L的亚硫酸钠和碳酸钠的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为 .
已知:H2SO3: K1=1.54×10﹣2 , K2=1.02×10﹣7 ;HClO: K1=2.95×10﹣8
H2CO3 : K1=4.3×10﹣7 , K2=5.6×10﹣11 .
-
(1) 电解饱和食盐水的化学方程式是
-
(2) 电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用;
-
(3) 用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.某次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的(填化学式)和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42﹣ , 解释其原因
[已知:Ksp(BaSO4)=1.1×10﹣10、Ksp(BaCO3)=5.1×10﹣9].
-
(4) 食盐水中若含有NH4+ , 会在阳极产生难溶于水的NCl3 , 写出该电极反应式.
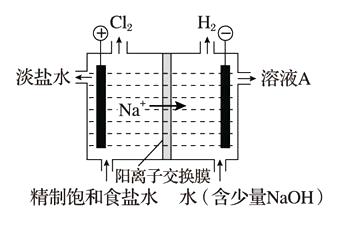
-
(1) 溶液A的溶质是。
-
(2) 电解饱和食盐水的离子方程式是。
-
(3) 电解时用盐酸控制阳极区溶液的pH在2~3。用化学平衡移动原理解释盐酸的作用:。
-
(4) 电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42- [c(SO42-)>c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
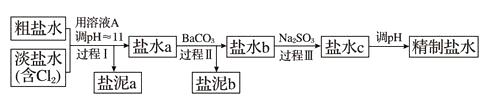
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是。
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有。
-
(1) 在电解过程中,所发生反应的离子方程式为。
-
(2) 电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42- 等杂质离子,使用的试剂有:
a.Na2CO3溶液b.Ba(OH)2溶液c.稀盐酸其中合理的加入顺序为(填写序号);
-
(3) 某小型氯碱厂采用电解氯化钠溶液的方法生产氯气、氢气和氢氧化钠.该工厂平均每天生产质量分数为40.0%的氢氧化钠溶液20吨.回答下列问题:
①该工厂平均每天至少需要多少吨的氯化钠?
②理论上,该工厂平均每天生产标准状况下的氯气的体积为多少升?
③已知质量分数为40%的氢氧化钠溶液密度为1.4g/cm,求该溶液物质的量浓度?
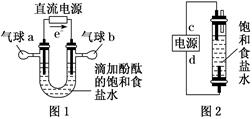
-
(1) 图1中,电解一段时间后,气球b中的气体是(填化学式),U形管(填“左”或“右”)边的溶液变红。
-
(2) 利用图2制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的极;该发生器中反应的总离子方程式为。
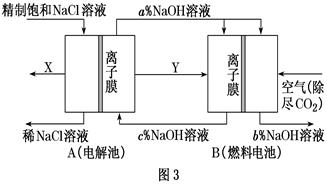
-
(3) 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图3所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
燃料电池B中的电极反应式分别为
负极,
正极。
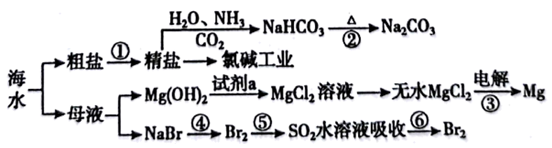
下列有关说法正确的是( )
| 序号 | A | B | C | D |
| 实例 | 泡沫灭火器 | 氯碱工业 | 溶洞的形成 | 三元催化尾气处理器 |
| 原理 | 盐类水解 | 电解原理 | 沉淀溶解平衡 | 平衡移动原理 |
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
 代表阿伏加德罗常数的值。下列说法正确的是( )
代表阿伏加德罗常数的值。下列说法正确的是( )
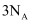 B .
B . 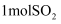 与足量
与足量 反应,可以得到
反应,可以得到 个
个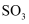 分子
C . 常温下,
分子
C . 常温下,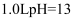 的
的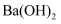 溶液中含有的
溶液中含有的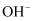 数目为
数目为 D . 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为
D . 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为







