以氯碱工业为基础的化工生产简介 知识点题库
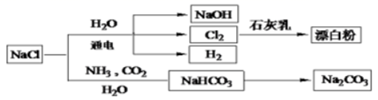
NaCl是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )

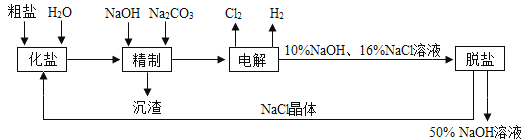
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”).
(2)为有效除去Ca2+、Mg2+、SO42﹣ , 加入试剂及合理顺序为
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2 , 相应的化学方程式为 .
(4)用石墨电极作阴极,铁电极作阳极电解水时往往产生大量的红棕色沉淀,请用化学反应解释这一现象: .
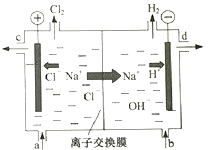
-
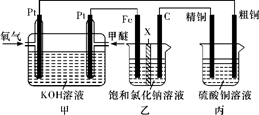
(1) 写出电解饱和食盐水的离子方程式.
-
(2) 精制饱和食盐水从图中位置补充,氢氧化钠溶液从图中位置流出.(选填“a”、“b”、“c”或“d”)
-
(3) 室温下,0.1mol/L次氯酸钠溶液的pH0.1mol/L亚硫酸钠溶液的pH.(选填“大于”、“小于”、“等于”)浓度均为0.1mol/L的亚硫酸钠和碳酸钠的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为.
已知:H2SO3 K1=1.54×10﹣2 K2=1.02×10﹣7 HClO K1=2.95×10﹣8
H2CO3 K1=4.3×10﹣7 K2=5.6×10﹣11 .
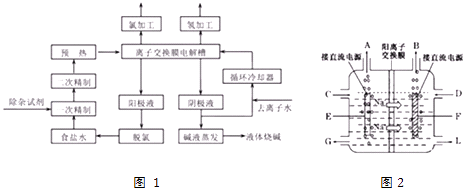
-
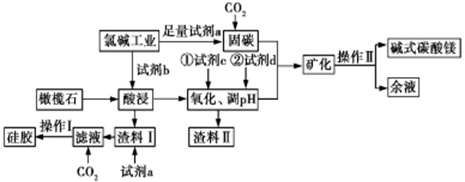
(1) 该流程中可以循环的物质是.
-
(2) 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42﹣等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水.
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl
B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl
D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+ , 需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果.
-
(3) 图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是,F电极的名称是.电解总反应的离子方程式为.
-
(4) 从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为.
-
(5) 已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3 , 电解槽的电流强度1.45×104A,该电解槽的电解效率为(保留两位小数).
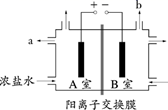
-
(1) Mg9FeSi5O20中铁的化合价为 ,为提高镁的浸出率 ,可采取的两种主要措施是 ,渣料Ⅱ的成分是。
-
(2) 若试剂c是氯碱工业中生成的某种气体 ,写出加入c后反应的离子方程式 ,试剂d的用途是调节溶液pH ,其成分是 ,余液中溶质的主要成分是。
-
(3) 操作Ⅰ的内容是 ,若固碳后溶液中的阴离子主要为CO
 ,写出生成碱式碳酸镁的离子方程式。
,写出生成碱式碳酸镁的离子方程式。
-
(1) 电解饱和食盐水制取氯气的化学方程式是。
-
(2) 下列说法错误的是______。A . 可采用碱石灰干燥氯气 B . 可通过排饱和食盐水法收集氯气 C . 常温下,可通过加压使氯气液化而储存于钢瓶中 D . 工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
-
(3) 在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)⇌Cl2(aq) K1=c(Cl2)/p
Cl2(aq) + H2O(l)⇌H+ (aq)+Cl- (aq) + HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)⇌Cl2(aq)的焓变ΔH10。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
-
(4) 工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4 , 相应的化学方程式为;
I.TiO2(s)+2Cl2(g)⇌TiCl4(g)+O2(g) ΔHI=181 mol·L-1 , KI=-3.4×10-29
II.2C(s)+O2(g)⇌2CO(g) ΔHII= - 221 mol·L-1 , KII=1.2×1048
结合数据说明氯化过程中加碳的理由 。
-
(5) 在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5 mol·L-1 , 反应30 min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。A . 适当提高反应温度 B . 改变催化剂 C . 适当降低反应温度 D . 改变反应物浓度
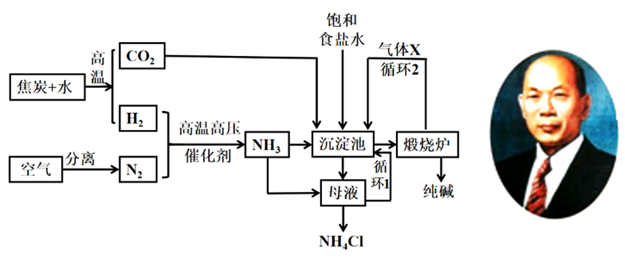
以下说法中错误的是( )
 、
、 、NaOH——电解池能将电能转化为化学能
C . 用聚合氯化铝净化生活用水——胶粒具有吸附作用
D . 用小苏打焙制糕点——小苏打能使蛋白质变性
、NaOH——电解池能将电能转化为化学能
C . 用聚合氯化铝净化生活用水——胶粒具有吸附作用
D . 用小苏打焙制糕点——小苏打能使蛋白质变性



