以氯碱工业为基础的化工生产简介 知识点题库


图1 图2
-
(1) 向沉淀池中通入CO2和氮气时,应先通入氮气的原因是;
-
(2) 沉淀池中发生反应的化学反应方程式是 ;
-
(3) 氨碱法生产流程示意图的Y是 ,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ;
-
(4) 联合制碱法中从滤液中提取氯化铵晶体的过程推测,所得结论正确的是 (选填编号)
A.常温时氯化铵的溶解度比氯化钠小
B.通入氨气能增大NH4+的浓度,使氯化铵更多析出
C.加入食盐细粉能提高Na+的浓度,使NaHCO3结晶析出
D.通入氨气能使NaHCO3转化为Na2CO3 , 提高析出的NH4Cl纯度
-
(5) 联合剂碱法相比于氨碱法,氯化钠利用率从70%提高到90%以上,主要是设计了循环I.联合制碱法的另一项优点是 .
-
(6) 从沉淀地析出的晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液确定(用甲基酸提示剂),测定值记录如下:
滴定次数
待测液(mL)
0.6000mol/L盐酸溶液的体积(mL)
初读数
终读数
第一次
20.00
1.00
21.00
第二次
20.00
如图2Ⅰ
如图2Ⅱ
①第二次滴定,从图Ⅰ图Ⅱ显示消耗的盐酸溶液体积为 ;
②该实验测定NaHCO3含量的计算式为ω(NaHCO3)= .
 CH3CH2OH
B . 制盐酸:H2+Cl2
CH3CH2OH
B . 制盐酸:H2+Cl2 2 HCl
C . 制烧碱:2NaCl+2H2O
2 HCl
C . 制烧碱:2NaCl+2H2O  2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
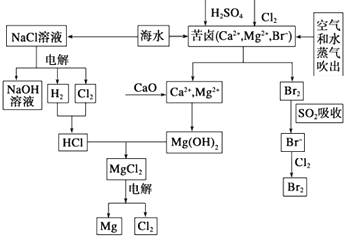
-
(1) 由海水晒制的粗盐中含有Ca2+、Mg2+、SO42﹣等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式).
-
(2) ①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是(写2条),电解饱和食盐水的化学反应方程式为.
②制取MgCl2的过程中涉及反应:MgCl2•6H2O
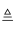 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是.
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是. -
(3) 苦卤中通入Cl2置换出Br2 , 吹出后用SO2吸收,写出用SO2吸收发生的离子方程式,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为.
-
(4) 也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出.该反应的离子方程式是;最后再用H2SO4处理得到Br2 , 之后加入CCl4进行Br2的萃取,最终用方法得到单质Br2 .
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
下列有关说法正确的是( )
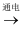 NaClO+H2↑
NaClO+H2↑

 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
-
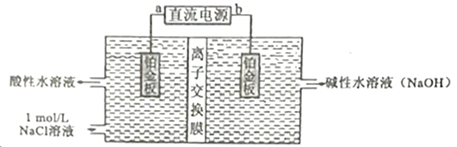
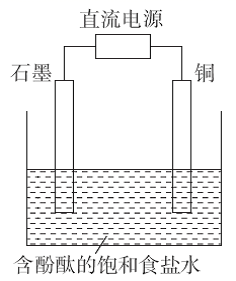
(1) 工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出工业上制取氯气的化学方程式:,该反应中氧化产物是(填化学式)
②写出二氧化锰与浓盐酸反应制取氯气的化学方程式:该反应中氧化剂和还原剂的物质的量之比为
③实验室中用高锰酸钾与浓盐酸反应制取氯气的化学方程式为: 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,有3.01×1022个电子发生转移时,生成的氯气的体积约为 (STP)
④用高锰酸钾和二氧化锰制备等量的氯气,被氧化的HCl的物质的量之比为。
-
(2) 由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84消毒液”
①将氯气入石灰乳(工业上先煅烧石灰石或贝壳,再加水反应来获得石灰乳)中可以制得漂白粉,写出该反应的化学方程式:,并用双线桥法标出该反应的电子转移方向和数目。
②漂白粉长时间暴露在空气中会变质,其原因是。
③氯气和氢氧化钠溶液反应可制得“84消毒液”。“84消毒液”和洁厕灵(主要成分是稀盐酸)不能混合使用,其原因是。
-
(3) 含氯消毒剂的消毒能力可以用氧化性来衡量,商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某“84消毒液”与4.26g氯气的氧化能力相当(即该产品的“有效氯”为4.26%),则100g该产品中次氯酸钠的质量为。

回答下列问题:
-
(1) 实验室中由粗盐制取精盐的过程中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是。
-
(2) 电解饱和食盐水的离子方程式为。
-
(3) 在溴工业中富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为。
-
(4) 镁工业为使苦卤中的Mg2+完全转化为Mg(OH)2(离子浓度小于10-5 mol·L-1时,沉淀就达完全),溶液的pH至少要控制在[常温下,Mg(OH)2的Ksp≈1×10-11];Mg(OH)2沉淀完全后,过滤,沉淀用盐酸酸化,从MgCl2溶液制得无水MgCl2 , 应如何操作。
-
(5) 海水中也有丰富的锂资源,我国科学家研发出利用太阳能从海水中提取金属锂的技术,提取原理如下图所示:
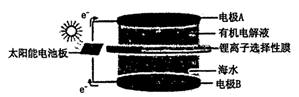
①金属锂在电极(填“A”或“B”)上生成。
②阳极产生两种气体单质,电极反应式是。
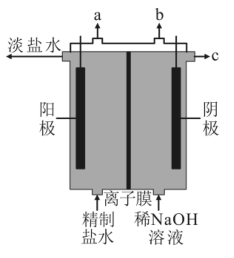
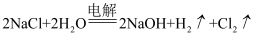 B . 阳极电极反应式:
B . 阳极电极反应式: 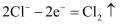 C . 离子膜应为阳离子交换膜
D . 每生成1molCl2 , 此装置共转移电子4mol
C . 离子膜应为阳离子交换膜
D . 每生成1molCl2 , 此装置共转移电子4mol
-
(1) 一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。
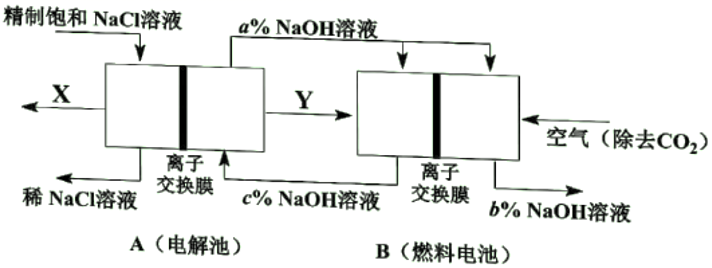
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。
-
(2) 降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为。
-
(1) 利用1:氯碱工业
从海水中提取粗盐的方法是。
-
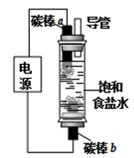
(2) 图1是氯碱工业中电解饱和氯化钠溶液的示意图,饱和氯化钠溶液从a口进入,NaOH溶液从(填b或d)口导出。阳离子交换膜的作用是。
-
(3) 图2是电解氯化钠溶液的微观示意图。X为电源的极,水合钠离子、水合氯离子吸引水分子的氢原子朝向不同的原因。

-
(4) 利用2:提镁工业
从海水中提取镁的流程图如下,按示例所示补全缺少的流程:。


下列说法正确的是( )
 通过
D . 阳极电极反应式为2H++2e-=H2↑
通过
D . 阳极电极反应式为2H++2e-=H2↑



