海水资源及其综合利用 知识点题库
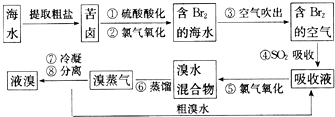
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )

-
(1) 溴在周期表中位于第周期,第族.
-
(2) 步骤②中反应的离子方程式是.
-
(3) 步骤④利用了SO2的还原性,反应的离子方程式为.
-
(4) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是.
-
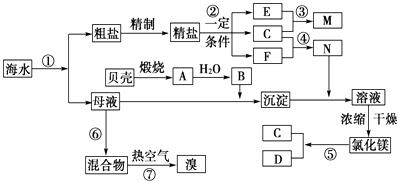
(1) Ⅰ.①写出N的化学式;
②写出反应②的化学方程式.
-
(2) Ⅱ.粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时所用的试剂为:①盐酸②氯化钡溶液③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为 .A . ②③④① B . ③④②① C . ④③②① D . ③②④①
-
(3) Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2 .
①若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是.
A.分解反应 B.化合反应C.置换反应 D.复分解反应
②若用来提取Br2 , 反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是.
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
③母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2乙:母液先提取Br2 , 后提取Mg
请你判断哪个更合适?(填“甲”或“乙),理由是.
 Mg(OH)2
Mg(OH)2  MgCl2溶液→MgCl2→MgCl2(熔解)
MgCl2溶液→MgCl2→MgCl2(熔解)  Mg
Mg
①把贝壳制成石灰乳;
②在引有海水的水渠中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④将得到的产物熔融后电解.
关于提取镁,下列说法正确的是( )
-
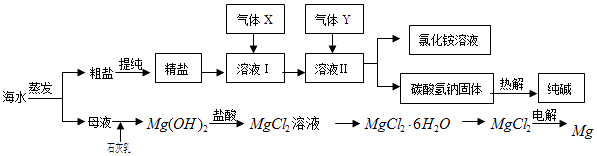
(1) 粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤;⑥加适量的盐酸;⑦.(填操作名称)
-
(2) 流程中通入的气体X为,理由是.
-
(3) 溶液Ⅱ中发生反应的化学方程式是:.
-
(4) 高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,试写出该反应的化学方程式.
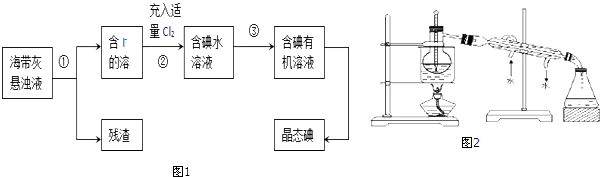
-
(1) 指出上图中提取碘的过程中有关的实验操作名称:①.
-
(2) 操作③中所用的有机试剂可以是(只填一种).
-
(3) 操作过程③可以分解为如下几步:
A. 把盛有溶液的分液漏斗放在铁架台的铁圈中;
B. 把50ml碘水和15ml有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C. 检验分液漏斗活塞和上口的玻璃塞是否漏液;
D. 倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E. 旋开活塞,用烧杯接收溶液;
F. 从分液漏斗上口倒出上层液体;
G. 将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H. 静置、分层.
(a)过程③正确操作步骤的顺序是:(填编号字母);
(b)上述G步操作的目的是:;
(c)最后碘的有机溶液是通过 获得(填“漏斗上口”或“漏斗下口”).
-
(4) 从含碘的有机溶液中提取碘和回收有机试剂,还需要经过蒸馏,观察图2所示实验装置指出其错误之处.
干海带  海带灰
海带灰  浸泡液
浸泡液  I2(CCl4)→I2
I2(CCl4)→I2
从A~C中选择适当的装置填空(填字母): 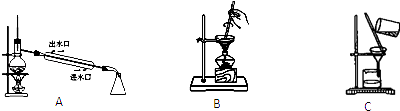
-
(1) 过滤操作时用到的装置是.
-
(2) 从I2的CCl4溶液中提取单质I2并回收CCl4的可用装置.
-
(3) 萃取分液时用到的主要玻璃仪器是,分液后得到的下层液体颜色为.
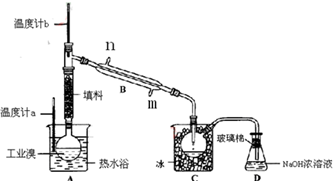
-
(1) 装置B直形冷凝管进水方向(填“Ⅱ”或“Ⅲ”),装置D的名称是。
-
(2) 在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是(填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
-
(3) 整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
-
(4) 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
-
(5) 装置C的作用:。装置D的作用是。
-
(6) 提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并;用CCl4提取溴时,产物应该从分液漏斗的(填“上口倒出”或“下口放出”)。
-
(1) 海水晒盐可获得粗盐,在实验室中粗盐经过溶解、、可制得精盐。(填具体操作名称)
-
(2) 镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①为了使MgSO4转化为Mg(OH)2 , 试剂①可以选用。
②试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是。
A.Mg(OH)
 MgO
MgO  Mg B.Mg(OH)
Mg B.Mg(OH)  MgO
MgO  Mg
MgC.Mg(OH)2
 MgCl2
MgCl2  Mg D.Mg(OH)2
Mg D.Mg(OH)2  MgCl2
MgCl2  Mg
Mg -
(3) 溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
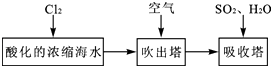
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
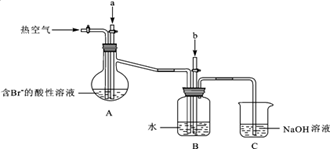
①A装置中通入a气体的目的是(用离子方程式表示);
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是;
③反应过程中,B装置中有SO42﹣生成,检验SO42﹣的方法是;
④C装置的作用是。
 B . 过滤含碘离子溶液
B . 过滤含碘离子溶液 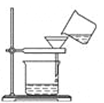 C . 放出碘的苯溶液
C . 放出碘的苯溶液 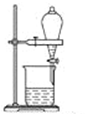 D . 分离碘并回收苯
D . 分离碘并回收苯 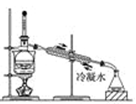
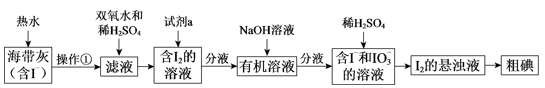
-
(1) 操作①的名称是。
-
(2) 向滤液中加入双氧水的作用是。
-
(3) 试剂a可以是(填序号)。
①四氯化碳 ②苯 ③酒精 ④乙酸
-
(4) I–和IO3-在酸性条件下生成I2的离子方程式是。
-
(5) 上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是。
-
(1) 在工业生产中金属冶炼的原理错误的是_
A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3 来制取 Al
C CO 还原 Fe2O3 制取 Fe
D 铝热反应原理制锰:4Al+3MnO2
 3Mn+2 Al2O3
3Mn+2 Al2O3 -
(2) 下图是从海水中提取溴的简单流程:

提取溴的过程中,经过 2 次 Br-
 Br2 转化的目的是
Br2 转化的目的是 -
(3) 吸收塔中发生反应的离子方程式是
-
(4) 海带中富含碘元素,实验室从海带中提取 I2 的途径如下图所示:
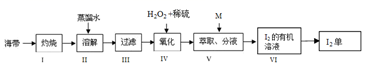
①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是 。
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③步骤 V 加入萃取剂 M 为 ,步骤 VI 从 I2 的有机溶液获得 I2 可以用 的方法。
| 选项 | 生产活动 | 化学原理 |
| A | 用聚乙烯塑料制作食品保鲜膜 | 聚乙烯燃烧生成 |
| B | 利用海水制取溴和镁单质 | |
| C | 利用氢氟酸刻蚀石英制作艺术品 | 氢氟酸可与 |
| D | 公园的钢铁护栏涂刷多彩防锈漆 | 钢铁与潮湿空气隔绝可防止腐蚀 |
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降,过滤,洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤,干燥产物;
④冶炼③的产物得到金属Mg。
关于提取镁,下列说法错误的是( )
 和
和 
 可被氧化、
可被氧化、  可被还原
可被还原 反应
反应


