海水资源及其综合利用 知识点题库
-
(1)
目前,国际上使用的“海水淡化”技术主要有蒸馏法、膜分离方法、电渗析法等.
(1)蒸馏法所需玻璃仪器有酒精灯、锥形瓶、尾接管和 、 .
(2)电渗析法原理如图1所示:
①淡水从 口(填“a”或“b”)流出;为了防止海水中的SO42﹣、Ca2+、Mg2+堵塞交换膜,需加入药品对之净化除去,则药品加入顺序次依是NaOH、 、


②电渗析法制取淡水的过程中产生的电解产物,用来处理二氧化硫的废气并回收二氧化硫及氯化钠,其循环的流程如图2.请写出反应、有关的化学反应方程式:
-
(2) 海水中蕴含着丰富的化学资源如镁、钾、铀.
(3)从海水中提取镁的部分步骤如下:
m.将蒸发结晶得到的MgCl2•6H2O在一定条件下加热,得到无水MgCl2;
n.电解熔融的氯化镁制金属镁.
步骤m中的“一定条件”指的是 ,目的是 ;步骤n不用熔融氧化镁制金属镁的原因是
(4)铀是核反应最重要的燃料之一,已经研制成功一种螯合型离子交换树脂,它专门吸附海水中的U4+ , 而不吸附其他元素.其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为

 H2O可转变为D2O
B . “加碘食盐”生产中碘添加剂为单质I2
C . 实验室用带玻璃塞的棕色瓶贮存液Br2
D . 电解饱和MgCl2溶液时在阴极得到Mg
H2O可转变为D2O
B . “加碘食盐”生产中碘添加剂为单质I2
C . 实验室用带玻璃塞的棕色瓶贮存液Br2
D . 电解饱和MgCl2溶液时在阴极得到Mg

-
(1) 利用海水可制备Cl2 , 为便于储存,可将Cl2液化,应采取的措施之一是.
-
(2) 粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解 ②加过量的BaCl2溶液 ③加过量的NaOH溶液 ④加过量的Na2CO3溶液 ⑤(填操作名称,下同) ⑥加适量的盐酸 ⑦
-
(3) 气体X为.溶液b中发生反应的化学方程式是.
-
(4) 步骤I中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 其目的为.步骤Ⅱ中通入空气吹出Br2 , 用SO2水溶液进行吸收,得到溶液c,反应的离子方程式为.在实验室中,从工业溴中提取溴单质的实验操作名称是.
-
(5) 工业上制取金属镁的化学方程式为.
-
(1) 海水中盐的开发利用:
①海水制盐目前以盐田法为t,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:(写一点即可).
-
(2) 电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题:
①海水不能直接通入到阴极室中,理由是.
②A口排出的是(填“淡水”或“浓水”)

-
(3) 用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下

①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为:
②通过①氯化已获得含Br2的溶液.为何还需经过吹出、吸收、酸化重新获得含Br2的溶液?.
③向蒸馏塔中通入水蒸气加热.控制温度在90℃左右进行蒸馏的原因是.

-
(1) 灼烧海带时需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处).A . 坩埚 B . 坩埚钳 C . 三脚架 D . 泥三角 E . 酒精灯
-
(2) 过程②中充入足量Cl2的目的是,反应的离子方程式为.
-
(3) 操作③中所用的有机试剂可以是(只填一种).
-
(4) 操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选)加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,不时旋开活塞放气,后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是;
b.最后碘的有机溶液是通过获得(填“漏斗上口”或“漏斗下口”).
-
(5) 若要检验提取碘后的水溶液中是否还含有单质碘,可以取样加入,观察颜色变化.
-
(6) 从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察图所示实验装置,指出其错误有处.


已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.( )

-
(1) 提取溴的过程中,经过2次
 转化的目的是,吸收塔中发生反应的离子方程式是
转化的目的是,吸收塔中发生反应的离子方程式是  ,蒸馏塔中发生反应的离子方程式是。
,蒸馏塔中发生反应的离子方程式是。
-
(2) 从
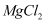 溶液中得到
溶液中得到  晶体的主要操作是、、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是。
晶体的主要操作是、、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是。
-
(3) 据上述流程,将
 海水中溴元素(海水中
海水中溴元素(海水中  离子含量为
离子含量为  )转化为工业溴,整个流程中至少需要标准状况下
)转化为工业溴,整个流程中至少需要标准状况下  的体积为L(忽略
的体积为L(忽略  溶解)。
溶解)。


上述流程中步骤A~D对应的装置图正确的是( )
-
(1) 海水淡化的方法有蒸馏法、(填1种方法)。
-
(2) 海水中制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为。
-
(3) 利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
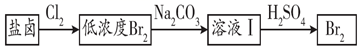
将Br2与Na2CO3反应的化学方程式补充完整:
Br2+Na2CO3=NaBrO3+ +
-
(4) 盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

已知:常温下0.010 mol·L-1金属离子在不同pH下的沉淀情况如下:
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
Mg(OH)2
9.6
11.1
①步骤②中需控制pH=9.8,其目的是。
②NaClO还能除去盐卤中的CO(NH2)2 , 生成盐和一种能参与大气循环的物质。除去0.2 mol CO(NH2)2时消耗NaClO g。
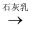 Mg(OH)2
Mg(OH)2  MgCl2溶液→MgCl2·6H2O
MgCl2溶液→MgCl2·6H2O  MgCl2(熔融)
MgCl2(熔融)  Mg[
C . 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D . 除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
Mg[
C . 从海水获得的碘,可以跟氧气反应生成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是I4O9
D . 除去粗盐中的SO42 -、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
 是形成酸雨的主要物质
是形成酸雨的主要物质
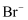 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程如下:下列说法不正确的是( )
形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程如下:下列说法不正确的是( ) A.浓缩海水是为了富集溴元素
A.浓缩海水是为了富集溴元素
 氧化”的离子方程式:2Br-+Cl2=Br2+2Cl-
氧化”的离子方程式:2Br-+Cl2=Br2+2Cl-



