氧化还原反应 知识点题库
下列变化需要加入氧化剂才能实现的是( )
A . HCl→H2
B . NaCl→Cl2
C . CuSO4→Cu
D . Na2CO3→CO2
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2 , 下列说法正确的是( )
A . 氧气是氧化产物
B . O2F2既是氧化剂又是还原剂
C . 若生成4.48 L HF,则转移0.8 mol电子
D . 还原剂与氧化剂的物质的量之比为1:4
过氧化氢(O为﹣1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2+H2O2+2H+=Mn2++O2↑+2H2O
②Mn2++H2O2=MnO2+2H+
下列说法正确的是( )
A . H2O2在①中是氧化剂,在②中是还原剂
B . 在①中每生成1 mol O2 , 转移的电子数为1.204×1024
C . Mn2+在①中是还原产物,在②中是氧化产物
D . 在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2
在一定条件下,氯气可与氯化铵发生如下反应:xCl2+NH4Cl═yNClx+(x+y)HCl,当消耗6.72L标准状况下的Cl2时,生成0.100mol氮的氯化物,则此氮的氯化物的化学式为( )
A . NCl2
B . NCl3
C . NCl4
D . NCl5
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25.0 mL 0.100 mol·L-1 Na2S2O3溶液恰好把224 mL Cl2(标准状况下)完全转化为Cl- , 则S2O32-将转化为( )
A . SO42-
B . S
C . SO32-
D . S2-
下列过程中发生氧化还原反应的是( )
A . Cu和稀HNO3反应
B . Fe的导电
C . NaHCO3受热分解
D . 实验室用NH4Cl和Ca(OH)2反应制取NH3
工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法中正确的是( )
A . NaClO3在反应中失去电子
B . SO2在反应中被氧化
C . H2SO4在反应中作氧化剂
D . 1 mol氧化剂在反应中得到2 mol电子
下列反应既属于吸热反应又属于氧化还原反应的是( )
A . 铁与稀硫酸反应
B . 灼热的碳与CO2的反应
C . Ba(OH)2•8H2O与NH4Cl的反应
D . 乙烷在氧气中的燃烧反应
下列颜色变化与氧化还原无关的是( )
A . 湿润的红色布条遇到氯气褪色
B . 棕黄色的FeCl3饱和溶液滴入沸水中变红褐色
C . 紫色酸性KMnO4溶液通入乙烯气体后褪色
D . 浅黄色Na2O2固体露置于空气中逐渐变为白色
根据常温下在溶液中发生的反应:①2B-+Z2=B2+2Z- , ②2A2++B2=2A3++2B- , ③16H++10Z-+2 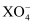 =2X2++5Z2+8H2O 可以判断下列说法中正确的是( )
=2X2++5Z2+8H2O 可以判断下列说法中正确的是( )
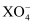 =2X2++5Z2+8H2O 可以判断下列说法中正确的是( )
=2X2++5Z2+8H2O 可以判断下列说法中正确的是( )
A . 还原性由强到弱的顺序是:A2+> B−> Z−> X2+
B . 氧化性由强到弱的顺序是:A3+> B2>Z2> 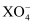 C . 反应 2Z− + 2A3+ = Z2 + 2A2+可以进行
D . 在含有A2+和B−的溶液中逐滴加入含Z2的溶液,A2+先被氧化,B−后被氧化
C . 反应 2Z− + 2A3+ = Z2 + 2A2+可以进行
D . 在含有A2+和B−的溶液中逐滴加入含Z2的溶液,A2+先被氧化,B−后被氧化
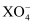 C . 反应 2Z− + 2A3+ = Z2 + 2A2+可以进行
D . 在含有A2+和B−的溶液中逐滴加入含Z2的溶液,A2+先被氧化,B−后被氧化
C . 反应 2Z− + 2A3+ = Z2 + 2A2+可以进行
D . 在含有A2+和B−的溶液中逐滴加入含Z2的溶液,A2+先被氧化,B−后被氧化
水与下列物质反应时,水表现出氧化性的是( )
A . Na
B . Cl2
C . Na2O2
D . Na2O
下列说法中正确的是( )
A . 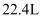 的
的  通入足量稀硝酸,电子转移
通入足量稀硝酸,电子转移 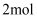 B . 标况下,
B . 标况下, 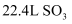 溶于水形成
溶于水形成 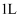 的溶液,所得溶液的物质的量浓度为
的溶液,所得溶液的物质的量浓度为 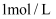 C . 常温下,将
C . 常温下,将  投入足量的浓硫酸中转移电子的物质的量为
投入足量的浓硫酸中转移电子的物质的量为  D . 用
D . 用  溶液吸收工业废气中的
溶液吸收工业废气中的  :
:  ,氧化剂与还原剂物质的量比为1∶1
,氧化剂与还原剂物质的量比为1∶1
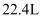 的
的  通入足量稀硝酸,电子转移
通入足量稀硝酸,电子转移 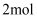 B . 标况下,
B . 标况下, 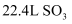 溶于水形成
溶于水形成 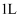 的溶液,所得溶液的物质的量浓度为
的溶液,所得溶液的物质的量浓度为 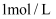 C . 常温下,将
C . 常温下,将  投入足量的浓硫酸中转移电子的物质的量为
投入足量的浓硫酸中转移电子的物质的量为  D . 用
D . 用  溶液吸收工业废气中的
溶液吸收工业废气中的  :
:  ,氧化剂与还原剂物质的量比为1∶1
,氧化剂与还原剂物质的量比为1∶1
冬季燃煤活动排放的大量活性溴化合物BrCl能通过光解释放溴自由基和氯自由基,从而影响大气中自由基(OH、HO2、RO2)的浓度,其原理循环如图所示。下列说法正确的是( )

A . 活性溴化合物BrCl中含非极性键
B . 溴自由基和氯自由基只具有氧化性
C . 通过循环大气中OH自由基的浓度降低
D . BrCl的排放会造成臭氧含量减少、水中汞含量超标等
将氯水分别滴加到盛有等浓度的 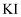 溶液、
溶液、  溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
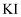 溶液、
溶液、  溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
A . 两支试管中溶液均呈紫色
B . 可证明还原性强弱:  C . 可证明氧化性强弱:
C . 可证明氧化性强弱:  D . 可证明
D . 可证明  的氧化性强于
的氧化性强于  和
和 
 C . 可证明氧化性强弱:
C . 可证明氧化性强弱:  D . 可证明
D . 可证明  的氧化性强于
的氧化性强于  和
和 
某化学研究性学习小组的同学根据理论分析推测出NO具有氧化性,他们设想利用如图所示装置验证NO的氧化性(已知2NO2+2OH- 
 +
+  +H2O,夹持装置已省略)。
+H2O,夹持装置已省略)。

 +
+  +H2O,夹持装置已省略)。
+H2O,夹持装置已省略)。 
-
(1) 判断NO有氧化性的理论依据是,本套装置气密性检查较简便的操作是,装置A中反应的离子方程式为。
-
(2) 装置C中试剂X是,装置B的作用是。
-
(3) 本套装置有一个明显的不正确,下列分析中正确的是_______(填标号)。A . 装置B中导管不应插入液面以下 B . 装置E无法吸收NO C . 实验开始后,应不断地向装置E中通入空气
-
(4) 实验结束时装置D中试管内得到黑色粉末,对黑色粉末的成分,小组的同学提出了不同的看法:
a.是FeOb.是Fe3O4c.是FeO与Fe3O4
①甲同学认为仅用磁铁就可以确定黑色粉末的成分到底是哪种情况,他判断的依据与结论是。
②若用化学方法分析a组和c组中的黑色粉末,则需要使用三种试剂,这三种试剂是。
有以下五个化学反应:
①2Na+2H2O=2NaOH+H2↑
②2KMnO4  K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
③CaCO3+2HCl=CaCl2+H2O+CO2↑
④C2H5OH+3O2  2CO2+3H2O
2CO2+3H2O
⑤CO2+CaO=CaCO3
其中属于化合反应的是(填序号,下同),属于分解反应的是,属于复分解反应的是,属于置换反应的是,属于氧化还原反应的是。
将高温水蒸气通到硫氰化钾的表面,会发生如下反应:4KSCN+9H2O(g)→K2CO3+K2S+3CO2+3H2S+4NH3。
完成下列填空:
-
(1) 画出硫原子的结构示意图,写出K2S的电子式。
-
(2) K2CO3中含有的化学键有,属于晶体。
-
(3) K2S水溶液呈(选填“酸性”、“碱性”或“中性”),溶液中c(K+)与c(S2-)之比2:1(选填“>”、“<”或“=”)。
-
(4) K2S接触潮湿银器表面时,出现黑色斑点(Ag2S),其化学反应如下:2K2S+4Ag+O2+2H2O→2Ag2S+4KOH
①标出上述反应电子转移方向和数目。
②标准状况下,每消耗224mLO2 , 转移电子的数目为个。
下列说法正确的是( )
A . 不可以用氨水鉴别AlCl3溶液和AgNO3溶液
B . SO2有漂白性因而可使品红溶液、溴水褪色。
C . 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝说明Fe3+能与淀粉发生显色反应
D . ClO2具有强氧化性,可以用于自来水杀菌消毒
下列实验中,不能观察到明显变化的是( )
A . 将一块绿豆大小的钾投入到盛有水的烧杯中
B . 将少量溴水加入到盛有KI溶液的试管中,振荡,加入  ,振荡、静置
C . 取一小段镁带,用砂纸除去表面的氧化膜,放入冷水中
D . 将乙烯通入酸性高锰酸钾溶液中
,振荡、静置
C . 取一小段镁带,用砂纸除去表面的氧化膜,放入冷水中
D . 将乙烯通入酸性高锰酸钾溶液中
 ,振荡、静置
C . 取一小段镁带,用砂纸除去表面的氧化膜,放入冷水中
D . 将乙烯通入酸性高锰酸钾溶液中
,振荡、静置
C . 取一小段镁带,用砂纸除去表面的氧化膜,放入冷水中
D . 将乙烯通入酸性高锰酸钾溶液中
利用某含铁矿渣(Fe2O3约40%、Al2O3约10%、MgO约5%、SiO2约45%)制备草酸合铁(III)酸钾晶体{化学式为K3[Fe(C2O4)3·3H2O]}的流程如下:

已知:草酸合铁(Ⅲ)酸钾晶体易溶于水且溶解度随温度升高明显增大,难溶于乙醇,对光敏感,光照下即发生分解;草酸钾微溶于乙醇。
回答下列问题:
-
(1) “焙烧”的目的是;滤渣的主要成分为(写化学式)。
-
(2) “净化”时,滴加氨水除去Al3+ , 若常温时, Ksp[Al(OH)3]=1.0 ×10-32 , 理论上使Al3+恰好沉淀完全[即溶液中c(Al3+ )=1×10-5 mol· L-1]时,溶液的pH为。
-
(3) “氧化”这一步 ,是依次加入一定量的饱和K2C2O4溶液、H2C2O4溶液、3%H2O2溶液,不断搅拌溶液并维持在40℃左右。充分反应后,沉淀溶解,溶液的pH保持在4~5,此时溶液呈翠绿色,趁热将溶液过滤到烧杯中,(补充必要的步骤) ,得草酸合铁( III )酸钾晶体。
-
(4) 写出“氧化”时反应的离子方程式:;“氧化”时,加入H2O2溶液的量过多,会使产品纯度下降的原因是。
-
(5) 草酸合铁(Ⅲ )酸钾晶体光照下立即发生分解生成两种草酸盐 、CO2等,写出该反应的化学方程式:。
最近更新



