氧化还原反应 知识点题库
已知:2Fe+3Br2═2FeBr3 , Fe2+的还原性大于Br﹣ . 现有16.8g铁和0.3mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2 . 下列叙述不正确的是( )
A . 当a=0.1时,发生的反应为2Fe2++Cl2═2Fe3++2Cl﹣
B . 当a=0.45时,发生的反应为2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣
C . 若溶液中Br﹣有一半被氧化时,c(Fe3+):c(Br﹣):c(Cl﹣)=1:1:3
D . 当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl﹣)+c(Br﹣)+c(OH﹣)
下列反应中,既属于氧化还原反应又属于置换反应的是( )
A . CuO+H2  Cu+H2O
B . CO2+Ca(OH)2
Cu+H2O
B . CO2+Ca(OH)2  CaCO3↓+H2O
C . Fe2O3+3CO═2Fe+3CO2
D . 2Na+Cl2═2NaCl
CaCO3↓+H2O
C . Fe2O3+3CO═2Fe+3CO2
D . 2Na+Cl2═2NaCl
 Cu+H2O
B . CO2+Ca(OH)2
Cu+H2O
B . CO2+Ca(OH)2  CaCO3↓+H2O
C . Fe2O3+3CO═2Fe+3CO2
D . 2Na+Cl2═2NaCl
CaCO3↓+H2O
C . Fe2O3+3CO═2Fe+3CO2
D . 2Na+Cl2═2NaCl
一未完成的离子方程式:( )+XO3﹣+6H+═3X2+3H2O,据此判断下列说法正确的是( )
A . X原子最外层有5个电子
B . 当有1mol X2生成时,共有2mol电子转移
C . 氧化产物和还原产物的物质的量之比为5:1
D . “( )”所填的微粒和XO3﹣在任何环境下都不能共存
下列物质在生话中应用时,起还原作用的是( )
A . 明矾作净水剂
B . 甘油作护肤保湿剂
C . 漂粉精作消毒剂
D . 铁粉作食品袋内的脱氧剂
根据问题填空:
-
(1) 实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目;该反应中,氧化产物是,还原产物是,氧化产物与还原产物的物质的量之比是.
-
(2) 化学镀镍的溶液中含有Ni2+和H2PO2﹣在酸性条件下发生如下反应,请配平该反应.
Ni2++H2PO2﹣+→Ni++H2PO3﹣+
分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A . H2SO4是酸,因为H2SO4中含有氢元素
B . 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C . Na和H2O的反应不是离子反应,因为反应中没有离子参加
D . Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧
钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

-
(1) 途径I碱浸时发生反应的化学反应方程式为。
-
(2) 途径II氧化时还有Na2SO4生成,则反应的离子方程式为。
-
(3) 已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8 , 忽略溶液的体积变化]。
-
(4) 分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的气体一起通入水中,得到正盐的化学式是。
-
(5) 钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1 , 则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓度为(计算结果保留3位有效数字)。
-
(6) 二硫化钼用作电池的正极材料时接受Li+的嵌入,锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2
 Lix(MoS2)n。则电池放电时正极的电极反应是:。
Lix(MoS2)n。则电池放电时正极的电极反应是:。
化学与生产、生活、科技等密切相关,下列说法正确的是( )
A . 用石油制取乙烯、丙烯等化工原料不涉及化学变化
B . 高纯硅具有良好的半导体性能,可制光导纤维
C . 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
D . 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒
下列变化不能通过一步反应直接完成的是( )
A . Na→Na2O2
B . C→CO2
C . S→SO3
D . Fe→Fe3O4
下列反应的离子方程式错误的是( )
A . 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B . 氢氧化钠溶液与盐酸反应:OH- +H+=H2O
C . 氯气与水反应:Cl2+H2O=H++ Cl-+ HClO
D . 氯化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
根据如图的转化关系判断下列说法正确的是(反应条件已略去):( )

A . 反应①②③④⑤均属于氧化还原反应和离子反应
B . 反应⑤说明该条件下铝的氧化性强于锰
C . 生成等量的O2 , 反应③和④转移的电子数之比为1:2
D . 反应①中氧化剂与还原剂的物质的量之比为1:4
为了除去物质中的杂质(括号内为杂质),选用试剂正确的是( )
| 物质 | 选用试刘 | |
| A | NaBr溶液(NaI) | 溴水 |
| B | CuCl2溶液(FeCl3) | 铜粉 |
| C | 乙烷(乙烯) | 氢气 |
| D | 溴苯(苯) | 液溴 |
A . A
B . B
C . C
D . D
向200mL FeBr2溶液中逐渐通入Cl2 , 其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法错误的是( )

A . 氧化性强弱:Br2>Fe3+
B . 由图可知,该FeBr2溶液的浓度为1mol•L─1
C . n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D . c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
下列反应中既属于化合反应,又属于氧化还原反应的是( )
A . SO2+H2O2=H2SO4
B . Zn+2AgNO3=Zn(NO3) 2+2Ag
C . 2HClO=2HCl+O2↑
D . CO2+2NaOH=Na2CO3+H2 O
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在溶液中的还原性顺序为:SO2>I->Fe2+>H2O2>Cl- , 则下列反应不可能发生的是( )
A . 2Fe3++SO2+2H2O=2Fe2++SO  +4H+
B . I2+SO2+2H2O=H2SO4+2HI
C . 2Fe2++I2=2Fe3++2I-
D . 2Fe2++Cl2=2Fe3++Cl-
+4H+
B . I2+SO2+2H2O=H2SO4+2HI
C . 2Fe2++I2=2Fe3++2I-
D . 2Fe2++Cl2=2Fe3++Cl-
 +4H+
B . I2+SO2+2H2O=H2SO4+2HI
C . 2Fe2++I2=2Fe3++2I-
D . 2Fe2++Cl2=2Fe3++Cl-
+4H+
B . I2+SO2+2H2O=H2SO4+2HI
C . 2Fe2++I2=2Fe3++2I-
D . 2Fe2++Cl2=2Fe3++Cl-
反应3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3中,氧化剂与还原剂的物质的量之比是( )
A . 4:3
B . 3:4
C . 1:3
D . 2:1
硫的化合物有重要用途。硫代硫酸钠(Na2S2O3)
可用于氰化物中毒的解毒、治疗荨麻疹等皮肤病,它在中性、碱性环境中稳定,在酸性较强的溶液中产生S和SO2。实验室可以利用如图装置制备Na2S2O3和焦亚硫酸钠(Na2S2O5 )。
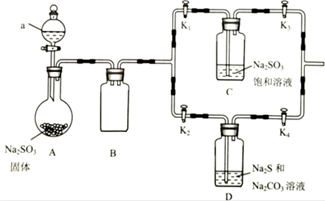
-
(1) 仪器a的名称为,a中试剂最好选择(填标号)。
A.浓盐酸 B.70%硫酸 C.稀硫酸
-
(2) B的作用是,该装置中存在一处明显的缺陷,改进措施是。
-
(3) 排尽装置内空气后,关闭K2、K4 , 打开K1、K3和仪器a的活塞,段时间后,C中有焦亚硫酸钠晶体析出,从C中分离出该晶体的操作是、、干燥。取少量焦亚硫酸钠晶体于试管中,加足量双氧水,再加BaCl2溶液,有白色沉淀生成,经检验该沉淀为BaSO4 , 说明焦亚硫酸钠具有性。
-
(4) 关闭K1、K3打开K2、K4 , 一段时间后,D中有Na2S2O3生成。写出SO2与Na2S和Na2CO3发生反应的化学方程式。通入D中的SO2不宜过量的原因是。
化学与生产、生活密切相关。下列说法正确的是( )
A . 雷雨天闪电时空气中有臭氧(O3)生成,O2和O3的相互转化是物理变化
B . 新型冠状病毒具有极强的传染性,可用84消毒液、过氧乙酸等进行环境消毒,是利用了其强氧化性
C . 以煤炭为主要燃料的地区,降落后的酸雨中的主要酸性物质是HNO3
D . 通常用石油的年产量来衡量一个国家的石油化学工业发展水平
废水脱氮工艺中有一种方法是在废水中加入过量的NaClO使NH  完全转化为N2 , 该反应可表示为2NH
完全转化为N2 , 该反应可表示为2NH  +3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中错误的是( )
+3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中错误的是( )
 完全转化为N2 , 该反应可表示为2NH
完全转化为N2 , 该反应可表示为2NH  +3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中错误的是( )
+3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中错误的是( )
A . 反应中每生成1molN2 , 转移3mol电子
B . 还原性:NH  <Cl-
C . 反应中NH
<Cl-
C . 反应中NH  被氧化,ClO-被还原
D . 经此法处理过的废水不可以直接排放
被氧化,ClO-被还原
D . 经此法处理过的废水不可以直接排放
 <Cl-
C . 反应中NH
<Cl-
C . 反应中NH  被氧化,ClO-被还原
D . 经此法处理过的废水不可以直接排放
被氧化,ClO-被还原
D . 经此法处理过的废水不可以直接排放
将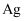 氧化铜和铜粉的混合物样品加入到体积为
氧化铜和铜粉的混合物样品加入到体积为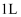 的
的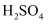 和
和 的混合溶液中,样品完全溶解,反应后溶液中只有
的混合溶液中,样品完全溶解,反应后溶液中只有 三种阳离子,且三种阳离子物质的量之比为
三种阳离子,且三种阳离子物质的量之比为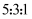 (不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的
(不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的 , 下列说法正确的是( )
, 下列说法正确的是( )
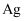 氧化铜和铜粉的混合物样品加入到体积为
氧化铜和铜粉的混合物样品加入到体积为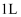 的
的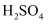 和
和 的混合溶液中,样品完全溶解,反应后溶液中只有
的混合溶液中,样品完全溶解,反应后溶液中只有 三种阳离子,且三种阳离子物质的量之比为
三种阳离子,且三种阳离子物质的量之比为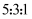 (不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的
(不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的 , 下列说法正确的是( )
, 下列说法正确的是( )
A . 原溶液中 为
为 B . 向反应前的溶液中加入足量铁粉,产生的气体体积为
B . 向反应前的溶液中加入足量铁粉,产生的气体体积为 C . 混合物中铜的质量分数为
C . 混合物中铜的质量分数为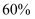 D . 将足量的
D . 将足量的 通入灼热的混合物,反应结束后,混合物的质量减少了
通入灼热的混合物,反应结束后,混合物的质量减少了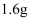
 为
为 B . 向反应前的溶液中加入足量铁粉,产生的气体体积为
B . 向反应前的溶液中加入足量铁粉,产生的气体体积为 C . 混合物中铜的质量分数为
C . 混合物中铜的质量分数为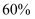 D . 将足量的
D . 将足量的 通入灼热的混合物,反应结束后,混合物的质量减少了
通入灼热的混合物,反应结束后,混合物的质量减少了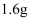
最近更新



