氧化还原反应 知识点题库
Na与水反应的化学方程式2Na + 2H2O == 2NaOH + H2↑,在反应中水( )
A . 是氧化剂
B . 是还原剂
C . 既是氧化剂又是还原剂
D . 既不是氧化剂又不是还原剂
下列化学反应中,既是离子反应,又是氧化还原反应的是( )
A . 2NaOH+H2SO4===Na2SO4+2H2O
B . Fe+H2SO4===FeSO4+H2↑
C . BaCl2+H2SO4===BaSO4↓+2HCl
D . H2+CuO===Cu+H2O
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7X+5FeSO4+12H2SO4 , 下列说法正确的是( )
A . X的化学式为CuS,它既是氧化产物又是还原产物
B . 5 mol FeS2发生反应,有10 mol电子转移
C . 产物中的SO42﹣离子有一部分是氧化产物
D . FeS2只作还原剂
向27.2gCuO、Cu的混合物中加入某浓度的稀HNO3500mL,固体完全溶解后,生成NO和Cu(NO3)2 . 在所得溶液中加入1mol/L 的NaOH溶液1L使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g.则:
-
(1) Cu与Cu2O 的物质的量之比为.
-
(2) HNO3的物质的量浓度为.
氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
-
(1) 水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用图表达.试写出有水参加的符合反应类型Ⅳ的一个化学方程式:,其中水为剂.
-
(2) 过氧化氢的水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
①下列反应中,H2O2既体现氧化性又体现还原性的反应是
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═K2CrO4+3K2SO4+8H2O
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是(填序号)

-
(3) 焊接铜器时,可先用NH4Cl 除去其表面的氧化铜再进行焊接,该反应可表示为:
4CuO+2NH4Cl
 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O①用双线桥标明电
 子转移的方向和数目..
子转移的方向和数目..②该反应中,被氧化的元素是,氧化剂是.
③还原剂与氧化产物的物质的量之比为.
④反应中若产生0.2mol的氮气,则有 mol的电子转移.

已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
A . 刺激性气味的气体是氨气
B . NH4CuSO3中硫元素被氧化
C . 1 mol NH4CuSO3完全反应转移0.5 mol电子
D . 反应中硫酸作氧化剂
24mL浓度为0.05mol•L﹣1 Na2SO3溶液恰好与20mL浓度为0.02mol•L﹣1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4 , 则元素X在还原产物中的化合价为下列的( )
A . +2 价
B . +3 价
C . +4价
D . +5价
根据问题填空:
-
(1) 在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况)反应方程式为MnO2+4HCl(浓)
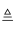 MnCl2+Cl2↑+2H2O,请用双线桥法标出该反应的电子转移的方向和数目.
MnCl2+Cl2↑+2H2O,请用双线桥法标出该反应的电子转移的方向和数目.
-
(2) 上述反应的还原剂是;被还原的元素是.
-
(3) 需要消耗MnO2多少克?若反应后溶液的体积不变,则反应后溶液中Cl﹣物质的量浓度是多少?(请在答卷上写出计算过程)
反应①②分别是从海藻灰和某种矿石中提取碘的主要反应,下列说法正确的是( )
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
A . 两个反应中硫元素均被氧化
B . 碘元素在反应①中被还原,在反应②中被氧化
C . 氧化性: MnO2>SO  >IO
>IO  >I2
D . 反应①②中生成等量I2时,转移电子数之比为1:5
>I2
D . 反应①②中生成等量I2时,转移电子数之比为1:5
下列反应中,属于氧化还原反应的是()
A . IBr+H2O=HIO+HBr
B . SO3+H2O=H2SO4
C . SO2+2KOH=K2SO3 +H2O
D . NaH+H2O=NaOH+H2↑
下列玻璃仪器的洗涤方法涉及氧化还原反应的是( )
A . 附有银镜的试管用稀硝酸清洗
B . 附有油脂的烧杯用热纯碱溶液清洗
C . 附有苯酚的试管用热的烧碱溶液清洗
D . 附有氢氧化铁的试管用盐酸清洗
废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2 , 该反应可表示为2NH4++3ClO-= N2+3Cl-+2H++3H2O。下列说法中,错误的是( )
A . 氧化性ClO- >N2
B . 还原性NH4+< Cl-
C . 反应中氮元素被氧化,氯元素被还原
D . 经此法处理过的废水不可以直接排放
下列反应一定是氧化还原反应的是( )
A . 分解反应
B . 化合反应
C . 置换反应
D . 复分解反应
下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是( )
①Fe + O2②Na2SiO3+CO2+ H2O ③NH4HCO3+NaOH
④Cu +Cl2⑤Ca(HCO3)2+Ca(OH)2
A . ④⑤
B . ②③
C . ①⑤
D . ①②⑤
-
(1) H2O2水溶液称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,对下列两个涉及H2O2的反应,填写下列空白:
A.H2O2 + Cl2 = 2HCl + O2 B.H2O2 + 2I- + 2H+ = I2 + 2H2O
① H2O2仅体现氧化性的反应是(填代号,下同)。
② H2O2仅体现还原性的是。
-
(2) 已知CuO具有氧化性,能够与NH3反应生成两种单质和H2O,请写出在加热条件下CuO与NH3反应的化学方程式。
-
(3) 在一定条件下,RO3n-与Cl2反应如下:RO3n-+ Cl2 + 2OH- = RO42- + 2Cl- + H2O由以上反应可知上述过程中RO3n-被(填“氧化”或“还原”),元素R的化合价是。
-
(4) 已知如下反应,请针对下述两个反应回答问题:
A 2H2O+Cl2+SO2=H2SO4+2HCl
B 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
① 两反应中的氧化剂的氧化性强弱顺序为,还原剂的还原性强弱顺序为(用物质的化学式表示)。
② 在反应②中氯化氢表现出的性质是。
a. 还原性 b. 酸性 c. 氧化性
含0.12mol的Na2SO3溶液,恰好与含0.04mol的K2Cr2O7溶液完全反应,已知Na2SO3溶液可被K2Cr2O7氧化为Na2SO4 , 则还原产物中Cr元素的化合价为( )
A . +1
B . +2
C . +3
D . +4
在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是( )
A . 反应中被氧化和被还原的元素分别为Cu和N
B . 反应中氧化剂和还原剂的物质的量之比为3∶2
C . 反应中产生0.2 mol气体时,转移0.6 mol电子
D . 该反应中被还原的CuO占参与反应CuO的 

下列物质常用作还原剂的是( )
A . 硝酸
B . 高锰酸钾
C . 氯气
D . 硫酸亚铁
混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案:

下列分析正确的是( )
A . 若m1>m2 , 则混合物M中一定含有Al2O3
B . 生成蓝色溶液的离子方程式为Cu+Fe3+=Cu2++Fe2+
C . 固体B既可能是纯净物,又可能是混合物
D . 要确定混合物M中是否含有Al,可取M加入适量盐酸
下列反应属于氧化还原反应的是( )
A . H2O+CaO=Ca(OH)2
B . Cu+2FeCl3=2FeCl2+CuCl2
C . NH4Cl NH3↑+HCl↑
D . CaCO3+2HCl=CaCl2+H2O+CO2↑
NH3↑+HCl↑
D . CaCO3+2HCl=CaCl2+H2O+CO2↑
 NH3↑+HCl↑
D . CaCO3+2HCl=CaCl2+H2O+CO2↑
NH3↑+HCl↑
D . CaCO3+2HCl=CaCl2+H2O+CO2↑
最近更新



