分子间作用力 知识点题库
下列说法正确的是( )
A . 分子间作用力与化学键的大小相当
B . 分子间作用力的大小远大于化学键,是一种很强的作用
C . 分子间作用力主要影响物质的化学性质
D . 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间的也存在相互作用,称为分子间作用力
下列物质性质的变化规律与分子间作用力有关的是( )
A . H2S、HCl的热稳定性依次增强
B . 金刚石的熔沸点高于晶体硅
C . NaF、NaCl、NaBr、NaI的熔点依次降低
D . CH4、SiH4、GeH4、SnH4的沸点逐渐升高
①分子之间存在着一种把分子 叫做分子间作用力,又称 .
②分子间作用力比化学键 ,它主要影响物质的 、 、 等物理性质,化学键属分子内作用力,主要影响物质的化学性质.
③一般来说,对于组成和结构相似的物质, 越大,分子间作用力 ,物质的熔点、沸点也越 .
④分子间作用力只存在于由分子组成的共价化合物、共价单质和稀有气体的分子之间.在离子化合物、金属单质、金刚石、晶体硅、二氧化硅等物质中只有化学键,没有分子间作用力.
下列物质发生状态变化时,克服了分子间相互作用力的是( )
A . 食盐熔化
B . 晶体硅熔化
C . 碘升华
D . 氢氧化钠熔化
当水的温度和压强升高到临界点(t=374.3℃,p=22.05MPa)以上时,水就处于超临界状态,该状态的水即称之为超临界水.超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机物质均匀混合.如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等小分子化合物.有关超临界水的叙述错误的是( )
A . 超临界水可处理有机废物
B . 超临界水是一种新物质
C . 超临界水是水的一种状态
D . 超临界水氧化技术不形成二次污染
在“  和
和  ”的变化过程中,被破坏的作用力依次是()
”的变化过程中,被破坏的作用力依次是()
 和
和  ”的变化过程中,被破坏的作用力依次是()
”的变化过程中,被破坏的作用力依次是()
A . 范德华力、范德华力
B . 范德华力、共价键
C . 共价键、离子键
D . 共价键、共价键
下列说法正确的是()
A . H2Se、H2S、H2O的热稳定性依次增强,是因为分子间作用力依次增大
B . 碘和氯化铝受热升华,吸收的热量用于克服了分子间作用力
C . NaHSO4、H2SO4的水溶液都能导电,所以它们都属于离子化合物
D . 金刚石和水晶都是共价化合物,都属于原子晶体
下列说法正确的是()
A . HCl属于共价化合物,溶于水能电离出H+和Cl-
B . NaOH是离子化合物,该物质中只含离子键
C . HI气体受热分解的过程中,只需克服分子间作用力
D . 石英和干冰均为原子晶体
下列说法不正确的是( )
A . 干冰升华和液氯气化时,都只需克服分子间作用力
B . 硫酸氢钠晶体溶于水,需要克服离子键和共价键
C . NH3和NCl3中,每个原子的最外层都具有8电子稳定结构
D . 石墨转化为金刚石时,既有共价键的断裂,又有共价键的形成
在“HI(s) → HI(g) → H2和I2”的变化过程中,被破坏的作用力依次是( )
A . 分子间作用力、分子间作用力
B . 分子间作用力、共价键
C . 共价键、离子键
D . 共价键、共价键
下列说法正确的是( )
A . 白磷(P4)分子中每个磷原子的最外电子层都形成了8电子的结构
B . MgCl2晶体中存在离子键和共价键
C . 碘发生升华时,吸收的热量用于克服分子间作用力和共价键
D . 碘化氢气体分解和石英熔化克服的化学键类型不同
下列有关分子与晶体的说法正确的是( )
A . 金刚石、氮化硼、C60熔化需克服的作用力类型相同
B . 晶体中有阴离子,必有阳离子;反之晶体中有阳离子,也必有阴离子
C . 钋单质为简单立方堆积,则晶胞中钋原子配位数为6
D . COS 与CO2互为等电子体,故COS 是直线形的非极性分子
下列说法错误的是( )
A . CH4分子填充模型:  B . 基态Si原子价电子排布图
B . 基态Si原子价电子排布图  C . 第一电离能:N>O>C
D . 石墨质软的原因是其层间作用力微弱
C . 第一电离能:N>O>C
D . 石墨质软的原因是其层间作用力微弱
下列说法中正确的是( )
①原子晶体中共价键越强,熔点越高②具有高熔、沸点的晶体一定是离子晶体或原子晶体③冰融化时水分子中共价键发生断裂④氯化钠熔化时离子键未被破坏⑤在晶体中只要有阴离子就一定有阳离子⑥分子间作用力越大,分子越稳定
A . ①②③④
B . ⑤⑥
C . ②④
D . ①⑤
已知Mn、Fe、Co是合金中的重要元素,而P、S、Cl是农药中的重要元素。请回答下列问题:
-
(1) 基态锰原子的价电子排布图为。
-
(2) 已知PCl3的沸点高于SCl2 , 原因是。
-
(3) 以无水乙醇作溶剂,Co(NO3)2可与某多齿配体结合形成具有催化活性的配合物,其结构如图所示,下列说法错误的是___________。
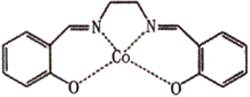 A . 第一电离能:H<O<N B . 该配合物中C原子的杂化方式均为sp C . 该配合物中Co原子的配位数为4 D . 基态Co原子核外电子的空间运动状态有27种
A . 第一电离能:H<O<N B . 该配合物中C原子的杂化方式均为sp C . 该配合物中Co原子的配位数为4 D . 基态Co原子核外电子的空间运动状态有27种 -
(4) 水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与Mn2+形成黄色的配合物。锰试剂的结构如图所示,其分子中可能与Mn2+形成配位键的原子有(填元素符号),锰试剂(填“能”或“不能”)形成分子内氢键。
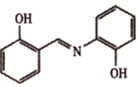
-
(5) 阿拉班达石(alabandite)是一种属于立方晶系的硫锰矿,其晶胞如图a所示(●=Mn,○=S)。在该晶胞中,硫原子的堆积方式为。
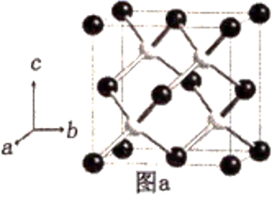
-
(6) 已知阿拉班达石晶胞中最近两个硫原子之间的距离为dÅ(1Å=10-10m),晶体密度为ρg▪cm-3 , 则阿伏加德罗常数的值NA=(不要求化简)。
-
(7) 为更清晰地展示晶胞中原子所在的位置,晶体化学中常将立体晶胞结构转化为平面投影图。例如:沿阿拉班达石晶胞的c轴将原子投影到ab平面,即可用图b表示。下列晶体结构投影图可能表示MnO2晶体的是___________。
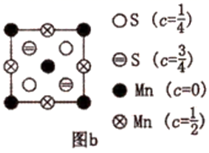 A .
A .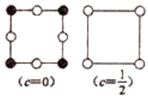 B .
B . 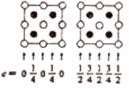 C .
C .  D .
D . 
硼酸(H3BO3)是玻璃工业、电子元件行业的重要原料。回答下列问题:
-
(1) 与B、O同周期,第一电离能介于二者之间的有(填元素符号)。
-
(2) 硼酸晶体结构为平面层状结构(如图I),四硼酸根为立体结构(如图Ⅱ)。

①硼酸为晶体;晶体中各层之间的作用力为。
②四硼酸根中硼原子的杂化方式为。
-
(3) 工业上曾用碳氨法制备硼酸,先用MgO·B2O3与NH4HCO3、H2O制得(NH4)H2BO3和MgCO3 , 然后再将(NH4)H2BO3脱NH3生成H3BO3。
①NH
 与CO
与CO  的空间构型:NH
的空间构型:NH  :CO
:CO  。
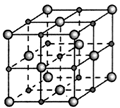
。②MgO晶体结构属于NaCl型(如图),图中表示Mg2+的为(填“大球”或“小球”),其配位数是;MgO晶胞参数为a pm,则MgO晶胞的密度为g·cm-3(NA表示阿伏加德罗常数的值,用含a、NA的式子表示)。
下列有关说法错误的是( )
A . CH4、C2H4、CO2分子中的键角依次增大
B . HF、HCl、HBr分子中的键长依次增长
C . H2O、H2S、H2Se分子中的键能依次减小
D . 分子中共价键的键能越大,对应物质的熔、沸点越高
汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。很多含巯基(-SH)的有机化合物是重金属元素求的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

-
(1) 汞的原子序数为80,与Zn属于同族元素,Hg价电子排布式为,位于元素周期表区。
-
(2) C、O、S分别形成的简单氢化物的沸点由高到低顺序为,理由。
-
(3) 预测化合物I溶解性为(填“难溶于水”或“易溶于水”);1mol化合物I中采取sp3杂化的原子数目是。
-
(4) 理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分锗原子被Hg和Sb取代后形成。

①图b为Ce晶胞中部分锗原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为;X晶体的化学式为:;设X的相对分子质量为
 ,则X晶体的密度为g·cm-3(列出计算式)。
,则X晶体的密度为g·cm-3(列出计算式)。
下列关于化学键的说法中错误的是( )
A . 化学键分为离子键、共价键、氢键等
B . 相邻的阳离子和阴离子之间强烈的相互作用称为离子键
C . 干冰晶体中存在共价键和分子间作用力
D . 金刚石晶体中只存在共价键,不存在分子间作用力
下列说法错误的是( )
A . 二氧化硅可用来制造光导纤维
B .  溶于水和干冰升华都只有分子间作用力改变
C . 氯气、臭氧、二氧化氯都可用于饮用水的消毒
D . 黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业
溶于水和干冰升华都只有分子间作用力改变
C . 氯气、臭氧、二氧化氯都可用于饮用水的消毒
D . 黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业
 溶于水和干冰升华都只有分子间作用力改变
C . 氯气、臭氧、二氧化氯都可用于饮用水的消毒
D . 黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业
溶于水和干冰升华都只有分子间作用力改变
C . 氯气、臭氧、二氧化氯都可用于饮用水的消毒
D . 黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业
最近更新



