分子间作用力 知识点题库
请回答下列问题:
-
(1) X2分子中σ键和π键数目比是.
-
(2) R的晶胞结构如图所示,该晶胞中所含的原子个数是.

-
(3) 下列有关X、Y、W的说法正确的是.
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3﹣中X的杂化轨道类型为sp3杂化
④W属于d区的元素
-
(4) 将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是.
-
(5) 将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是.
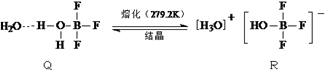
据此判断晶体Q中各种微粒间的作用力不涉及( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、H2O、H2S晶体的熔点依次降低
④离子化合物中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠溶于水时离子键被破坏
-
(1) 已知:25℃时,H2CO3的Ka1=4.30×10-7 , Ka2=5.61×10-11 , HClO的Ka=2.95×10-8 , 比较给出H+能力的相对强弱:H2CO3HClO(填“>”、“<”或“=”);请用一个化学方程式说明
 和ClO-结合H+能力的相对强弱。
和ClO-结合H+能力的相对强弱。
-
(2) CN2H4是离子化合物且各原子均满足稳定结构,写出CN2H4的电子式。
-
(3) 常压下,SO3的沸点(44.8℃)比SO2(-10℃)的沸点高,其主要原因是。
-
(1) 基态镓原子的价电子排布式为。
-
(2) 镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为和+3。砷的电负性比镓 (填“大”或“小”)。
-
(3) 比较下列镓的卤化物的熔点和沸点,GaCl3、GaBr3、GaI3的熔、沸点依次升高,分析其变化原因: 。
镓的卤化物
GaCl3
GaBr3
GaI3
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
GaF3的熔点超过1000℃,可能的原因是。
-
(4) ①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:。
②反应物AsH3分子的几何构型为,(CH3)3Ga中镓原子杂化方式为。
-
(5) 砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,As的配位数为,晶体的密度为 (设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

-
(1) E在元素周期表中位于区。
-
(2) B、C、D的原子半径由大到小的顺序为(填元素符号),A分别与B、C、D能形成10电子的化合物,它们的沸点由高到低的顺序是(填分子式)。
-
(3) C2A4在碱性溶液中能够将ED还原为E2D。C2A4分子中C的杂化方式是,由C元素原子组成的单质分子(C2)中含个π键,与单质分子(C2)互为等电子体的分子有。
-
(1) 认识元素周期表的结构:

①在元素周期表中,第ⅠB、ⅡB元素属于区。
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素的中文名称,分别为“
 (nǐ)”“镆(mò)”“
(nǐ)”“镆(mò)”“  (tián)”“
(tián)”“  (ào)”,则下列说法正确的是(填字母序号)。
(ào)”,则下列说法正确的是(填字母序号)。a.115号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
-
(2) 认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的,该元素M能层上具有种不同运动状态的电子。
-
(3) 认识元素周期律及其应用:
①第三周期元素的第一电离能:DE(填“>”“<”或“=”)。
②气态氢化物的沸点:BF(填“>”“<”或“=”),理由是。
 +9H2。
+9H2。  的结构如图。回答下列问题:
的结构如图。回答下列问题: 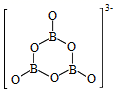
-
(1) 写出O原子价电子轨道式。
-
(2) 写出NH3BH3分子的电子式;NH3BH3晶体中含有的微粒间作用力有(填标号)。
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
-
(3) NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-)。上述化学反应中,所含元素电负性由小到大的顺序为(填元素符号);反应方程式中五种微粒含有sp3杂化原子的微粒有(填微粒化学式)。
-
(4) 有机碱离子
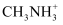 是NH3BH3的等电子体,该离子与Pb2+、I-组成的光电材料,其晶胞如图所示:
是NH3BH3的等电子体,该离子与Pb2+、I-组成的光电材料,其晶胞如图所示: 
该晶体中
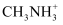 离子与I-离子间的作用力为,
离子与I-离子间的作用力为, 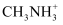 的配位数是。若晶胞参数为apm,该晶体密度为ρg·cm-3 , 阿伏加德罗常数NA可表示为mol-1(列出计算式)。
的配位数是。若晶胞参数为apm,该晶体密度为ρg·cm-3 , 阿伏加德罗常数NA可表示为mol-1(列出计算式)。
 可作为下列有机合成反应的催化剂。下列说法正确的是 ( )
可作为下列有机合成反应的催化剂。下列说法正确的是 ( )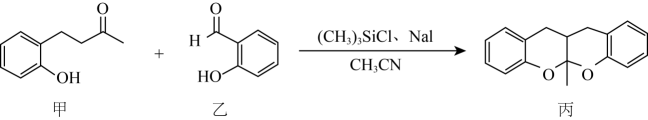
 中σ键与π键的个数相等
B . 甲分子中采取
中σ键与π键的个数相等
B . 甲分子中采取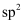 杂化的碳原子有6个
C . 有机物乙的沸点低于对羟基苯甲醛(
杂化的碳原子有6个
C . 有机物乙的沸点低于对羟基苯甲醛( 中
中 键比
键比 中
中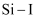 键易断裂
键易断裂
选项 | M组 | N组 |
A | 酸性强弱:三氟乙酸>三氯乙酸 | F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大 |
B |
| 因为 |
C |
|
|
D | HI的沸点比HCl的高 | H-I键的键能大于H-Cl键的键能 |
 的稳定性大于
的稳定性大于



